
 图是 ,第一电离能最小的元素的原子轨道表达式_______________________。
图是 ,第一电离能最小的元素的原子轨道表达式_______________________。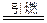 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平) _________________
_________________ 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源:不详 题型:填空题
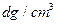 ,其摩尔质量为
,其摩尔质量为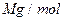 ,则该晶胞的体积是 。(请列出算式)
,则该晶胞的体积是 。(请列出算式)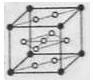
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | H2 | O2 | F2 | O-H | O-F | H-F |
| E/(kJ/mol) | 432 | 494 | 155 | 424 | 220 | 566 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④ | B.①③ | C.①②③④ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

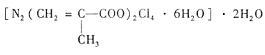 该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。
该化合物中存在的化学键类型有 。甲基丙烯酸分子中C原子的杂化方式有 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4、NH3、H2O、He | B.OH-、F-、O2-、Ne |
| C.NH4+、Na+、H3O+ | D.O2-、F-、Mg2+、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com