
已知: C(s)+O2(g) === CO2(g) ΔH=-393.5 kJ/mol
2CO(g)+O2(g) === 2CO2(g) ΔH=-566 kJ/mol
TiO2(s)+2Cl2(g) === TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s) === TiCl4(s)+2CO(g) ΔH= 。
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
下列溶液混合后,常温下溶液一定呈碱性的是
A.pH=12的氢氧化钠溶液与pH=2的某酸溶液等体积混合
B.pH=2的某酸溶液与pH=12某碱溶液等体积混合
C.pH=2的盐酸pH=12的氨水等体积混合
D.1×10-3mol/L的盐酸和6×10-4mol/L的Ba(OH)2溶液各取10mL,混合后再稀释100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修5 有机化学基础】(15分)
(15分)Q是合成防晒霜的主要成分,某同学以石油化工的基本产品为主要原料,设计合成Q的流程如下(部分反应条件和试剂未注明):
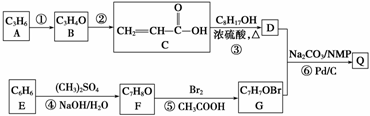
已知:
Ⅰ.钯催化的交叉偶联反应原理(R、R1为烃基或其他基团,X为卤素原子):
R—X+R1—CH===CH2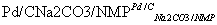 R1—CH===CH—R+H—X
R1—CH===CH—R+H—X
Ⅱ.C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与碳酸氢钠反应生成CO2,其消去产物的分子只有一个碳原子上没有氢原子。
Ⅲ.F不能与氢氧化钠溶液反应,G的核磁共振氢谱中有3个峰且为对位取代物。
请回答下列问题:
(1)反应⑤的反应类型为__________,G的结构简式为________________________。
(2)C中官能团的名称是____________________________________________________;
C8H17OH的名称(用系统命名法命名)为__________。
(3)X是F的同分异构体,X遇氯化铁溶液发生显色反应且环上的一溴取代物有两种,写出X的结构简式:________________________________________________________。
(4)写出反应⑥的化学方程式:______________________________________________。
(5)下列有关B、C的说法正确的是________(填序号)。
a.二者都能使溴的四氯化碳溶液或酸性高锰酸钾溶液褪色
b.二者都能与碳酸氢钠溶液反应产生二氧化碳
c.1 mol B或C都能最多消耗44.8 L(标准状况)氢气
d.二者都能与新制氢氧化铜悬浊液反应
分离提纯中间产物D的操作:先用饱和碳酸钠溶液除去C和浓硫酸,再用水洗涤,弃去水层,最终通过__________操作除去C8H17OH,精制得到D。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是

① ② ③ ④
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+===Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
临湘一中食堂以前烧煤,经过改造现在烧天然气,使校园环境有了很大的改善。天然气的主要成分是甲烷,若2克甲烷完全燃烧可放出QKJ的热量,请写出能表示甲烷燃烧热的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物W( )常用于合成维生素类药物。下列与W相关说法正确的是
)常用于合成维生素类药物。下列与W相关说法正确的是
A.分子式为C6H9O3
B.分子中含有2种官能团
C.分子中含有6种不同化学环境的氢原子
D.水溶液中lmolW可与3molNaOH完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
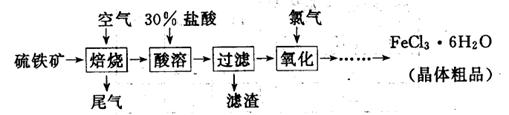
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
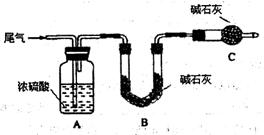
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 Na2CO3溶液:c(OH-)=c(HCO )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.0.1 mol·L-1 NH4Cl溶液:c(NH )=c(Cl-)
)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+) >c(NO )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是
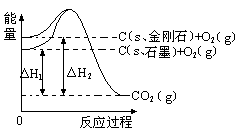
A.C(s石墨)= C(s金刚石)△H= +1.9 kJ•mol-1
B.金刚石的稳定性大于石墨
C.石墨和金刚石转化是物理变化
D.1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com