
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
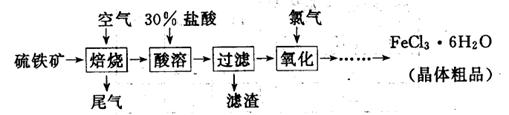
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
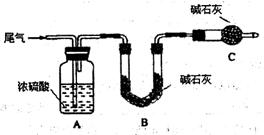
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
科目:高中化学 来源: 题型:
下物质分类组合正确的是( )
| A | B | C | D | |
| 强电解质 | HCl | FeCl3 | H3PO4 | HClO |
| 弱电解质 | HF | CH3COOH | BaSO4 | Ba(OH)2 |
| 非电解质 | NH3 | Cu | H2O | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: C(s)+O2(g) === CO2(g) ΔH=-393.5 kJ/mol
2CO(g)+O2(g) === 2CO2(g) ΔH=-566 kJ/mol
TiO2(s)+2Cl2(g) === TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s) === TiCl4(s)+2CO(g) ΔH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能完成相应实验的一项是
| 选项 | 实验器材(省略夹持装置) | 相应实验 l |
| A | 三脚架、泥三角、坩埚、坩埚钳 | 用CuSO4 |
| B | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用浓盐酸配制0.1mol·L-1的HCl溶液 |
| C | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
水与人类文明的发展密切相关,下列说法正确的是
A.4 ℃时,纯水的pH=7
B.温度升高,纯水中的c(H+)增大,c(OH-)减小
C.水的电离程度很小,纯水中主要存在形态是水分子
D.向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
查看答案和解析>>
科目:高中化学 来源: 题型:
常温条件下,下列各组比值为1∶2的是
A.0.1 mol/L Na2CO3溶液,c(CO32—)与c(Na+)之比
B.0.1 mol/L与0.2 mol/L 醋酸溶液,c(H+) 之比
C.pH=3的硫酸与醋酸溶液,c(SO42—)与c(CH3COO-)之比
D.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X和元素Y在周期表中位于相邻的两个周期,X和Y两原子核外电子总数之和为19,Y原子核内质子数比X多3个,下列叙述正确的是( )
A、X和Y都是性质活泼的元素,在自然界中不能以化合态存在
B、X和Y形成的化合物的化学式为Y2X3
C、X元素的最高价为+6价
D、Y能置换酸中氢,放出氢气。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1) ⑦元素最高价氧化物晶体类型是______________。
(2) ⑨所在族的各元素的氢化物中沸点最低的是________(写分子式)
(3)不同元素的原子在分子内吸引电子的能力大小可用电负性x来表示,若x越大说明该元素非金属性越强,比较x(⑧) x(⑨)(填>,< 或 =),写出一个支持这一比较的事实(用化学方程式表示) 。
(4) ①、④、⑤中的某两种或三种元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。
(5)元素③的氢化物与元素⑨的氢化物反应的化学方程式为 。已知第二周期ⅡA族元素性质与⑥相似,写出该元素最高价氧化物与NaOH溶液反应的离子方程式_________。
(6) 已知A为ⅡA族元素(第二到第七周期),其原子序数为a,B与A位于同一周期,且为ⅢA族元素,则B的原子序数b与a所有可能的关系是( )
A 、 b=a+1 B 、b=a+9 C、b=a+11 D、 b=a+15
(7) 由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(已知Z为白色沉淀)
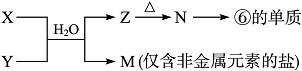
X溶液与Y溶液反应的离子方程式________, M中阳离子的检验方法____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com