
对已达化学平衡的下列反应:2X(g)+Y(g)⇌2Z(g)减小压强时,对反应产生的影响是( )
|
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
|
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
|
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 |
|
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
| 化学平衡的影响因素.. | |
| 专题: | 化学平衡专题. |
| 分析: | 对于有气体参加的化学反应,减小压强,正逆反应速率都减小;减小压强,化学平衡向气体体积增大的方向移动. |
| 解答: | 解:反应2X(g)+Y(g)2Z(g)有气体参加和生成,且该反应为气体体积缩小的反应,则减小压强时, A、正逆反应速率都减小,故A错误; B、正逆反应速率都减小,平衡逆向移动,故B错误; C、正、逆反应速率都减小,平衡向逆反应方向移动,故C正确; D、正、逆反应速率都减小,平衡向逆反应方向移动,故D错误; 故选C. |
| 点评: | 本题考查压强对反应速率及化学平衡的影响,明确化学反应为气体体积缩小的反应是解答本题的关键,难度不大. |


科目:高中化学 来源: 题型:
①等物质的量的CO和CO2所含原子个数比为 ,质量比为 。
②含硫原子数相同的SO2和SO3的物质的量之比是 ;含氧原子数相同的SO2
和SO3的质量之比是 ,物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的密闭容器一个盛有氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的 ( )
A.质量 B. 原子总数 C.电子总数 D.质子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
从如图所示的某气体反应的能量变化分析,以下判断错误的是( )
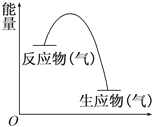
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应A(g)+B⇌C(g)+D达到平衡时,下列说法不正确的是( )
|
| A. | 若增大A的浓度,平衡体系颜色加深,D不一定是具有颜色的气体 |
|
| B. | 增大压强,平衡不移动,说明B、D必是气体 |
|
| C. | 升高温度,C的百分含量减小,说明正反应是放热反应 |
|
| D. | 若B是气体,增大A的浓度会使B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应:M(g)+N(g)⇌P(g)+Q(g)△H>0,请回答下列问题.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol•L﹣1,c(N)=2.4mol•L﹣1,达到平衡后,M的转化率为60%,此时N的转化率为 25% .
(2)若反应温度升高,M的转化率 增大 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,a= 6 .
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol•L﹣1,达到平衡后,M的转化率为 41% .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列几种物质:①H2O、②空气、③Mg、④CaO、⑤盐酸溶液、⑥Ca(OH)2、⑦C2H5OH、⑧蔗糖,属于电解质的是 ,属于强电解的是 ,属于非电解质的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是原子序数依次增大的4种短周期元素。其中X是周期表中原子半径最小
的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是( )
A. 由X、Y、Z三种元素组成的化合物中阴、阳离子所含电子数不等
B. X与Z为同主族元素,它们的单质与W单质反应得到的产物均只含离子键
C. Y与Z的单质在常温下反应生成Z2Y2
D. Y、Z、W三种元素组成的某种化合物可用于消毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com