
已知可逆反应:M(g)+N(g)⇌P(g)+Q(g)△H>0,请回答下列问题.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol•L﹣1,c(N)=2.4mol•L﹣1,达到平衡后,M的转化率为60%,此时N的转化率为 25% .
(2)若反应温度升高,M的转化率 增大 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,a= 6 .
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol•L﹣1,达到平衡后,M的转化率为 41% .
| 化学平衡的影响因素;化学平衡建立的过程;化学平衡的计算.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据M的转化率为60%计算出M的浓度变化量,利用浓度变化量之比等于化学计量数之比求出N的浓度变化量,再根据转化率定义计算; (2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大; (3)由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算; (4)设平衡时M的浓度变化量为xmol/L,由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算x的值,在利用转化率等于计算. |
| 解答: | 解:(1)△c(M)=60%×1mol•L﹣1=0.6mol•L﹣1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6mol•L﹣1,故此时N的转化率 (2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大,故答案为:增大; (3))△c(M)=60%×1mol•L﹣1=0.6mol•L﹣1,则: M(g)+N(g)⇌P(g)+Q(g); 初始(mol/L):1 2.4 0 0 转化(mol/L):0.6 0.6 0.6 0.6 平衡(mol/L):0.4 1.8 0.6 0.6 故该温度下平衡常数k= 反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,则: M(g)+N(g)⇌P(g)+Q(g); 初始(mol/L):4 a 0 0 转化(mol/L):2 2 2 2 平衡(mol/L):2 a﹣2 2 2 所以 故答案为:6; (4)设平衡时M的浓度变化量为为xmol/L,则: M(g)+N(g)⇌P(g)+Q(g); 初始(mol/L):b b 0 0 变化(mol/L):x x x x 平衡(mol/L):b﹣x b﹣x x x 所以 故M的转化率为 故答案为:41%. |
| 点评: | 本题考查化学平衡的有关计算、平衡常数的有关计算等,题目难度不大,注意理解化学平衡常数的用途,判断反应进行程度、判断反应进行的方向、计算转化率等. |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
元素的性质呈周期性变化的根本原因是
A、原子半径呈周期性变化
B、元素的化合价呈周期性变化
C、第一电离能呈周期性变化
D、元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液只含有Na+, Al3+, Cl-,SO42-四种离子,已知Na+, Al3+, Cl-的个数比为3:2:1。则溶液中Al3+与SO42-离子的个数比为( )
A.1:2 B.1:4 C.3:4 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.45mol/L•s,则反应所经历的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加0.6mol/L,在此时间内用H2表示的平均反应速率为0.45mol/L•s,则反应所经历的时间是( )
|
| A. | 2s | B. | 1s | C. | 0.67s | D. | 1.2s |
查看答案和解析>>
科目:高中化学 来源: 题型:
对已达化学平衡的下列反应:2X(g)+Y(g)⇌2Z(g)减小压强时,对反应产生的影响是( )
|
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
|
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
|
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 |
|
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
100 mL硝酸和硫酸的混合溶液中,加入50mL 4 mol·L-1的NaOH溶液,恰好完全中和,然后再向反应后的混合溶液中加入足量BaCl2溶液,可得到得沉淀11.65g
求:
⑴原混合溶液中H+的物质的量浓度。
⑵原混合溶液中所含HNO3的质量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
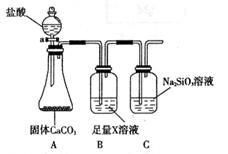 某化学课外活动小组为了验证元素非金属性递变规律,设计了如下图所示的两套实验方案进行实验探究:
某化学课外活动小组为了验证元素非金属性递变规律,设计了如下图所示的两套实验方案进行实验探究:
 方案一 方案二
方案一 方案二
(1)根据方案一装置回答以下问题:
 Ⅰ写出装置①发生的化学反应方程式:__________________________________________________。
Ⅰ写出装置①发生的化学反应方程式:__________________________________________________。
Ⅱ若将反应后②中的溶液倒入CCl4中,
出现的现象与右图吻合的是________。(填代号)
Ⅲ装置③中的现象是_____________________。
(2)根据方案二装置回答以下问题:
Ⅰ方案二验证元素非金属性递变的理论依据是:____________________________________。
ⅡB装置的作用是__________ ,X是_________________________。
Ⅲ能说明碳元素和硅元素非金属性强弱的实验现象是__________。
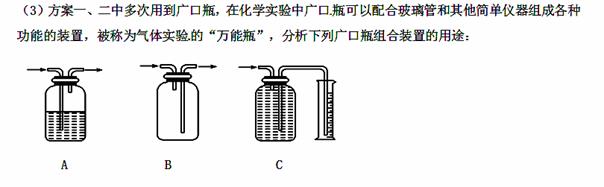
A__________________; B__________________; C__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com