
元素的性质呈周期性变化的根本原因是
A、原子半径呈周期性变化
B、元素的化合价呈周期性变化
C、第一电离能呈周期性变化
D、元素原子的核外电子排布呈周期性变化
科目:高中化学 来源: 题型:
下列有关离子方程式书写正确的
A.在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4
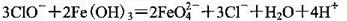
B.从酸化的海带灰浸出液中提取碘: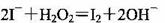
C.以金属银为阳极电解饱和硫酸铜溶液: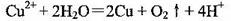
D.过氧化氢能使酸性KMnO4溶液褪色: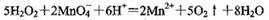
查看答案和解析>>
科目:高中化学 来源: 题型:
用Na2SO4固体配制0.2 mol/L Na2SO4溶液50mL。
(1)需要的玻璃仪器有50 mL容量瓶、烧杯、量筒、玻璃棒和 。
(2)用托盘天平称量Na2SO4固体的质量为 。
(3)下列操作对实验结果有何影响(填“偏高”、“偏低”、或“无影响”)
A、将烧杯中的溶液注入容量瓶后未洗涤烧杯。
B、定容时俯视容量瓶的刻度线。
C、选用的容量瓶内残留有少量蒸馏水。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验操作或事故处理方法不正确的是 ( )
A.碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液
B.浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液
C.酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭,不能用水泼灭
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
①等物质的量的CO和CO2所含原子个数比为 ,质量比为 。
②含硫原子数相同的SO2和SO3的物质的量之比是 ;含氧原子数相同的SO2
和SO3的质量之比是 ,物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏伽德罗常数的值为NA,下列结论错误的是
A、完全电解2molH2O断裂的σ键键数为4NA
B、标准状况下,11.2LCO2中含有的π键键数为2 NA
C、60gSiO2晶体中含有的Si—O键键数为4NA
D、12g金刚石中含有C—C键键数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化属于吸热反应的是( ).
①液态水气化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气
⑤生石灰与水反应生成熟石灰⑥水煤气反应⑦二氧化碳与赤热的炭反应生成一氧化碳
A.①④⑦ B.②③⑥ C. ①④⑤ D.②④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示
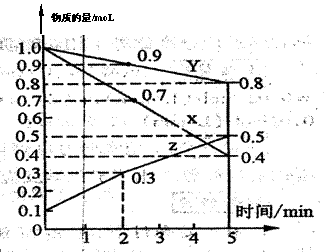 |
(1)由图中的数据分析,该反应的化学方程式为______________________________。
(2)反应开始至2min、5minZ的平均反应速率为______________、_______________。
(3)5min后Z的生成速率比5min末Z的生成速率__________(大、小、相等)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知可逆反应:M(g)+N(g)⇌P(g)+Q(g)△H>0,请回答下列问题.
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol•L﹣1,c(N)=2.4mol•L﹣1,达到平衡后,M的转化率为60%,此时N的转化率为 25% .
(2)若反应温度升高,M的转化率 增大 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,a= 6 .
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol•L﹣1,达到平衡后,M的转化率为 41% .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com