
分析 电子总数为10个电子的微粒有:分子有CH4、NH3、H2O、HF、Ne; 阴离子有N3-、O2-、F-、OH-、NH2-;阳离子有Na+、Mg2+、Al3+、NH4+、H3O+.
根据已知信息先确定出A,结合特征反应A+B═C+D(D为气体),可知生成的气体D为碱性气体,从而推得B、C、D.由反应A+E═2C分析,能够发生该反应的有:OH-+H3O+=2H2O,NH2-+NH4+=2NH3,结合前面得出信息即可确定.
解答 解:电子总数为10个电子的微粒有:分子:CH4、NH3、H2O、HF、Ne;阴离子:N3-、O2-、F-、OH-、NH2-;阳离子:Na+、Mg2+、Al3+、NH4+、H3O+.
根据题意,A是双原子的阴离子,确定A为OH-.反应A+B═C+D(D为气体),A为OH-,与B加热条件下反应生成D气体,说明D气体为碱性气体,而中学阶段碱性气体只有NH3,即D为NH3,则B为NH4+,C为H2O,方程式为:OH-+NH4+ $\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑.反应A+E═2C是同一物质相互之间反应,在10电子的微粒中有:OH-+H3O+=2H2O,NH2-+NH4+=2NH3,而已确定C为H2O,所以反应为OH-+H3O+=2H2O则E为H3O+.
答:A为OH-,B为NH4+,C为H2O,D为NH3,E为H3O+.
点评 本题主要考查10电子的微粒和这些微粒相互间的性质反应,注意水的自偶电离,解题的关键是熟知10电子微粒.


科目:高中化学 来源: 题型:解答题

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
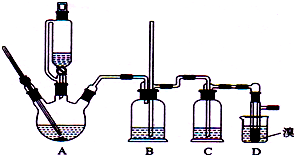 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
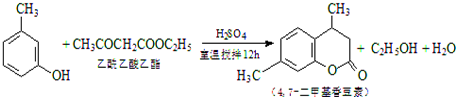
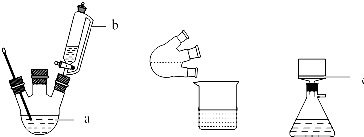
 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲乙两容器均为恒容容器,则x必等于2 | |
| B. | 若甲乙两容器均为恒压容器,则x必等于3 | |
| C. | 若甲为恒压容器,乙为恒容容器,且x不等于3,则n1必大于n2 | |
| D. | 若甲为恒容容器,乙为恒压容器,且x等于3,则n1必大于n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | NH4NO3 | C. | (NH4)2SO4 | D. | NH4Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com