
【题目】某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。

已知:①NaClO 在受热或酸性条件下易分解,3NaClO==2NaCl + NaClO3
②AgCl 可溶于氨水: AgCl+2NH3·H2O![]() Ag(NH3)2++Cl-+2H2O
Ag(NH3)2++Cl-+2H2O
③常温下,N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:
4 Ag(NH3)2++ N2H4·H2O ==4Ag↓+ N2 ↑+4NH4+ +4NH3 ↑+H2O
请回答下列问题:
(1)“氧化” 阶段需在80℃条件下进行,适宜的加热方式为____________________________。
(2)NaC1O溶液与Ag反应的产物为AgCl、NaOH 和O2,该反应的化学方程式为_____________。
(3)为提高AB的回收率,需对“过滤II”的滤渣进行洗涤,并_________________________。
(4)若省略“过滤I”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量次氯酸钠与氨水反应外(该条件下NaClO3 与氨水不反应),还因为___________________。
(5)利用题给信息,请设计从“过滤II”的滤液中获取单质Ag 的实验方案:____________(实验中须使用的试剂有: 2mol/L水合肼溶液,1mol/L H2SO4溶液)。
【答案】 水浴加热 4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2↑ 将洗涤后的滤液合并入过滤的滤液中 未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的氯离子,不利于氯化银与氨水的反应(氯离子影响平衡) 向滤液中滴加2mol/L水合肼溶液,搅拌使其充分反应,同时用1mol/LH2SO4溶液吸收反应中放出的氨气,待溶液中无气泡产生,停止滴加,静置,过滤,洗涤,干燥
【解析】1)已知“氧化”阶段需在80℃的条件下进行,温度变化范围较小,且低于100℃,因此适宜的加热方式为水浴加热;正确答案:水浴加热。
(2)NaC1O溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2↑;正确答案: 4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2↑。
(3) 为避免滤渣中含有未被溶解的银元素而导致银的流失,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤后的滤液合并入过滤Ⅱ的滤液中;正确答案:将洗涤后的滤液合并入过滤的滤液中。
(4) 若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量![]() 与
与![]() 反应外,还因为未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,使得已知反应②的平衡逆向移动,不利于AgCl与氨水反应;正确答案:未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的氯离子,不利于氯化银与氨水的反应(氯离子影响平衡) 。
反应外,还因为未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,使得已知反应②的平衡逆向移动,不利于AgCl与氨水反应;正确答案:未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的氯离子,不利于氯化银与氨水的反应(氯离子影响平衡) 。
(5) 根据已知条件③,水合肼能在碱性条件下将![]() 还原为
还原为![]() ,因此实验方案为向滤液中滴加
,因此实验方案为向滤液中滴加![]() 水合肼溶液,搅拌使其充分反应,同时用
水合肼溶液,搅拌使其充分反应,同时用![]() 溶液吸收反应中放出的
溶液吸收反应中放出的![]() 避免污染空气,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥;正确答案:向滤液中滴加2mol/L水合肼溶液,搅拌使其充分反应,同时用1mol/LH2SO4溶液吸收反应中放出的氨气,待溶液中无气泡产生,停止滴加,静置,过滤,洗涤,干燥。
避免污染空气,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥;正确答案:向滤液中滴加2mol/L水合肼溶液,搅拌使其充分反应,同时用1mol/LH2SO4溶液吸收反应中放出的氨气,待溶液中无气泡产生,停止滴加,静置,过滤,洗涤,干燥。


科目:高中化学 来源: 题型:
【题目】用铝片与1molL-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A.对该反应体系加热B.用浓硫酸代替稀盐酸
C.加入少量硫酸铜溶液D.加入少量1molL-1硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是( ) 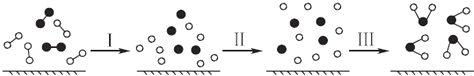
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学假说是科学发展的一种重要形式。有科学家提出: 利用空气中的二氧化碳与氢气反应后,使之变为可再生的燃料甲醇的设想。其设想的生产流程如图。下列说法正确的是

A. 上述流程中饱和碳酸钾溶液所起的作用是降低空气中的CO2 的溶解度
B. 上述流程中能体现“循环利用”的物质有碳酸氢钾溶液和高温水蒸气
C. 从合成塔中分离出甲醇的实验操作方法是分液
D. 通入高温水蒸气的作用是: 加快CO2的生成和逸出,以便及时提供给合成塔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的性质与应用关系的描述不正确的是()
A.氧化镁的熔点高,是优质的耐高温材料
B.金属钠着火,不可用泡沫灭火器灭火
C.氯气有强氧化性,可用氯气漂白干燥的有色布条
D.二氧化硫有漂白性,可用于漂白毛,丝,纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学分析法测得某有机物的化学成分及含量如下表所示,则该物质最可能是()
元素 | C | O | N | H | S | Fe |
含量(%) | 92.393 | 3.518 | 2.754 | 1.214 | 0.006 | 0.006 |
A. 核酸 B. 脂肪 C. 蛋白质 D. 糖类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,四种一元弱酸的电离平衡常数为:Ka(HCN)=6.2×10-10 mol/L、Ka(HF)=6.8×10-4 mol/L、Ka(CH3COOH)=1.8×10-5 mol/L、Ka(HNO2)=6.4×10-6 mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是( )
A. HCN B. CH3COOH C. HF D. HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如图: 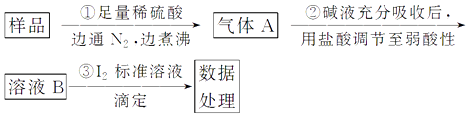
(1)碘标准液应选用(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行、洗涤、润洗.
(2)锥形瓶内的指示剂为 , 判断达到滴定终点的依据 .
(3)下列操作会使测定结果偏大的有
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品wg,按乙方案测得消耗0.010molL﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式______________。
(2)写出NH2Cl与水反应的化学方程式_____________________。
(3)一定条件下(T℃、latm),可以用Cl2(g)和NH3(g)制得NH2Cl(g) 同时得到HCl(g)。
已知部分化学键的键能如下表:
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式________________________。
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件,将物质的量之和为3mol的NO 和Cl2以不同的氮氯比(![]() )进行反应2NO(g)+Cl2(g)
)进行反应2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:
2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为: T1____T2(填“>”、“<”或“=”)
(5)图中纵坐标为物质(填化学式)_________的转化率,理由为______________。
(6)图中A、B、C 三点中平衡时NOCl体积分数最大的是__________(填“A”、“ B” 或“C”)
(7)若容器容积为1L,则B点平衡常数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com