
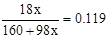 �����x=3
�����x=3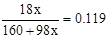 �����x=3 ��ΪCuSO4��3Cu(OH)2����2/3���������ˮ����Y������ϡ�����֪�ܽ�ijɷ�ΪCuSO4�������ʵ���Ϊ������2�����ɴ˿�֪��ɫ�м���ﺬ��Cu2+��SO42-�ĸ�����Ϊ2:1�����ݵ���غ��֪�仯ѧʽΪCu2OSO4��
�����x=3 ��ΪCuSO4��3Cu(OH)2����2/3���������ˮ����Y������ϡ�����֪�ܽ�ijɷ�ΪCuSO4�������ʵ���Ϊ������2�����ɴ˿�֪��ɫ�м���ﺬ��Cu2+��SO42-�ĸ�����Ϊ2:1�����ݵ���غ��֪�仯ѧʽΪCu2OSO4��

 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1mol�����μ�������ԭ��Ӧ��ת�Ƶĵ�����һ��Ϊ2NA |
| B��25��ʱ��1 L pH=12��Na2CO3��Һ�к���Na+����ĿΪ0.02NA |
| C��12 gʯī��C60�Ļ��������������һ��Ϊ6NA�� |
| D�����³�ѹ�£�22.4L��ϩ��C?H����Ϊ4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1mol��L��1 | B��0.1 mol��L��1 | C��0.01 mol��L��1 | D��10 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����״���£�11��2L�����������ķ�����Ϊ0��5NA |
| B��28g��ϩ�������õ��Ӷ���ĿΪ4NA |
| C��1 mol���ĵ�����ĿΪ7NA |
| D��������ϩ����ϩ����ϩ�Ļ�����干14g����ԭ����Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��32 |
| B��16 |
| C��32g?mo1��1 |
| D��16 g?mo1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����³�ѹ�£�32g O2���е�ԭ����Ϊ2NA |
| B��100mL 1mol��L-1��ˮ�У�����OH- ��������0.1 NA |
| C��100mL 2 mol��L-1̼������Һ�У�CO2-3������Ϊ0.2NA |
| D����״���£�22.4LCl2ͨ������NaOH��Һ��ת�Ƶĵ�����Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Ħ����һ����λ���������� |
| B��Ħ������������������������������������ |
| C��1mol�κ�������������ķ�����Ŀ����� |
| D��0��5mol��Լ����1��204��1024������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����M���ף���M���ң���������������ף��� |
| B����M���ף���M���ң����������ѹǿ���ף��� |
| C����M���ף���M���ң����������Ħ��������ף��� |
| D����M���ף���M���ң�����ķ��������ף��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CO��Ħ��������28g |
| B��1mol CO������������Ϊ6.02��1023�� |
| C��1 mol CO��������28 g / mol |
| D�����³�ѹ�£�1 mol CO�����Ϊ22.4 L |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com