
【题目】已知A、B、C、D四种元素的原子序数为A<B<C<D,且都小于18。A、B位于同周期,A元素的原子最外层电子数是次外层电子数的2倍,B元素的原子最外层电子数是次外层电子数的3倍。C、D同周期, C元素的原子半径在同周期中最大,D元素的原子最外层电子数比次外层电子数少1个。试推断:
(1)请写出A、B、C、D四种元素的元素符号:A________,B________,C________,D_______。
(2)画出D元素的离子结构示意图_______________。
(3)AB2中存在的化学键是 (离子键、共价键), CD的电子式为 。
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;
制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
![]()
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
(7)工业上,通过如下转化可制得KClO3晶体:![]()
完成Ⅰ中反应的总化学方程式:
![]()
Ⅱ该反应过程能析出KClO3晶体而无其他晶体析出的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。下列说法中不正确的是
A.蛋白质、棉花、PVC、淀粉都是混合物
B.废弃的玻璃、金属、纸制品是可回收利用的资源
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是
A.FeSO4(Fe) B.SnCl2(HCl) C.FeCl3(HCl) D.NaAlO2(NaOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明苯酚具有弱酸性的实验是()
A. 加入浓溴水生成白色沉淀
B. 苯酚钠溶液中通入CO2后,溶液由澄清变浑浊
C. 浑浊的苯酚加热后变澄清
D. 苯酚的水溶液中加NaOH溶液,生成苯酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ① 能使溴的四氯化碳溶液褪色, 常作植物生长调节剂; ②比例模型如图所示: ③能与水在一定条件下反应生成C |
B | C、H两种元素组成; ②球棍模型如图所示: |
C | ①C、H、O三种元素组成; ② 与Na反应产生H2; ③ 与D反应可生成酯。 |
D | ①C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
请回答下列问题:
(1)写出A、C的结构简式:A___ _____,C____ __;B的分子式为 。
(2)D物质中存在的官能团名称为____ __。
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为 。
(4)C催化氧化生成乙醛的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法、乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是__________;
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、玻璃棒、__________,操作Ⅱ的名称是__________;操作Ⅲ的名称是__________;
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。如图所示的是用燃烧法确定青蒿素分子式的装置。
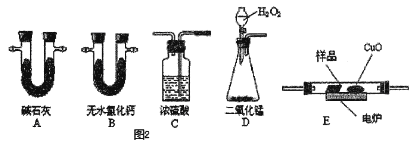
①按上述所给的测试信息。装置的连接顺序应是__________(每个装置限用一次)。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是__________;
③青蒿素样品的质量为28.2 g。用合理改进后的装置进行试验,称得A管增重66 g,B管增重19.8 g,则测得青蒿素的最简式是__________。
④要确定该有机物的分子式,还必须知道的数据是__________。
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,与青蒿素化学性质相似的物质是__________(填字母代号)
A.乙醇 B.乙酸 C.葡萄糖 D.乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示:
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率/% | 80 | α1 | α2 | |
下列判断中,正确的是( )
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com