
【题目】用双线桥法标出下列反应电子转移的方向和数目。
(1)4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O_________________
MnCl2+Cl2↑+2H2O_________________
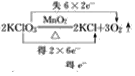
(2)2KClO3![]() 2KCl+3O2↑__________
2KCl+3O2↑__________
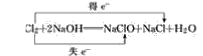
(3)Cl2+2NaOH===NaClO+NaCl+H2O__________
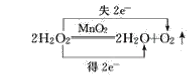
(4)2H2O2![]() 2H2O+O2↑__________
2H2O+O2↑__________
(5)S+2H2SO4(浓)![]() 3SO2↑+2H2O__________
3SO2↑+2H2O__________
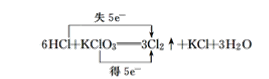
(6)6HCl+KClO3===3Cl2↑+KCl+3H2O__________
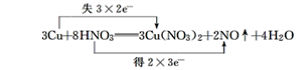
(7)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O__________
(8)2KMnO4![]() K2MnO4+MnO2+O2↑__________
K2MnO4+MnO2+O2↑__________
【答案】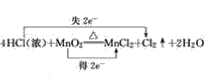


【解析】
计算、对比方程式中变价元素化合价的升降,确定元素化合价变化;结合在氧化还原反应中,若元素的化合价升高,则失去电子,发生氧化反应(被氧化);若元素的化合价降低,则得到电子,发生还原反应(被还原)。确定元素得电子还是失电子;然后计算得失电子的个数:得失电子的数目=化合价的变化值×化合物中变价元素原子个数×该化合物的化学计量数。
(1)反应中Mn的化合价由+4变为+2价,部分Cl的化合价由-1变为0价,则最小公倍数为2,则双线桥法为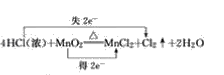 ;
;
(2) 反应中Cl的化合价由+5变为-1价,部分O的化合价由-2变为0价,则最小公倍数为12,则双线桥法为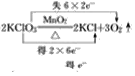 ;
;
(3)反应中部分Cl的化合价由0变为+1价,部分Cl的化合价由0变为-1价,则最小公倍数为1,则双线桥法为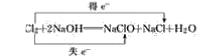 ;
;
(4)反应中部分O的化合价由-1变为-2价,部分O的化合价由-1变为0价,则最小公倍数为2,则双线桥法为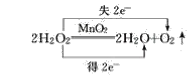 ;
;
(5) 反应硫酸中S的化合价由+6变为+4价,S的化合价由0变为+4价,则最小公倍数为4,则双线桥法为 ;
;
(6) 反应氯酸钾中Cl的化合价由+5变为0价,HCl中Cl的化合价由-1变为0价,则最小公倍数为5,则双线桥法为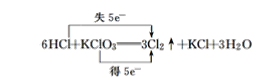 ;
;
(7) 反应中Cu的化合价由0变为+2价,N的化合价由+5变为+2价,则最小公倍数为6,则双线桥法为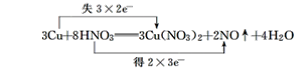 ;
;
(8) 反应中Mn的化合价由+7变为+4、+6价,O的化合价由-2变为0价,则最小公倍数为4,则双线桥法为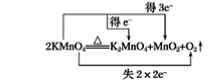 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国工程院院士、国家卫健委高级别专家组成员李兰娟团队,于2月4日公布阿比朵尔、达芦那韦可抑制新型病毒。如图所示有机物是合成阿比朵尔的原料,关于该有机物下列说法正确的是
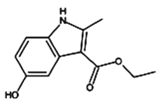
A.分子式为C12H14NO3
B.易溶于水和有机溶剂
C.分子结构中含有三种含氧官能团
D.可以发生加成反应、取代反应、水解反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,气态分子断开1mol化学键所需的能量称为键能。已知H-H,H-O,和O=O键的键能分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是( )
A.H2O(g)=H2(g)+![]() O2(g)△H=-485kJ/mol
O2(g)△H=-485kJ/mol
B.H2O(g)=H2(g)+![]() O2(g)△H=+485kJ/mol
O2(g)△H=+485kJ/mol
C.2H2(g)+O2(g)=2H2O(g)△H=+485kJ/mol
D.2H2(g)+O2(g)=2H2O(g)△H=-485kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;
Ⅱ.Cl2(g)+H2O(l)![]() HCl(aq)+HClO(aq)ΔH2;
HCl(aq)+HClO(aq)ΔH2;
Ⅲ.2HClO(aq)=2HCl(aq)+O2(g)ΔH3;
SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)
ΔH4=____________________(用含有ΔH1、ΔH2和ΔH3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
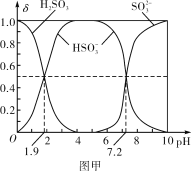
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因_____________________________________________________。
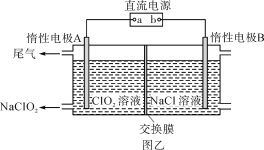
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)![]() S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
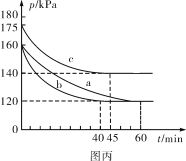
(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图丙所示:
①图丙中三组实验从反应开始至达到平衡时,v(CO)最大的为__________(填字母序号)。
②与实验a相比,c组改变的实验条件可能是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入等物质的量A、B,发生如下反应:2A(g)+2B(g)![]() 3C(s)+4D(g),平衡常数温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数温度和压强的变化如表所示:
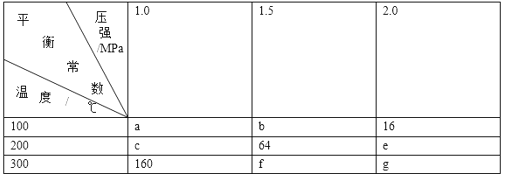
下列判断正确的是( )
A.g>f
B.△H<0
C.2.0MPa、300℃时,A的平衡转化率最小
D.1.5MPa、100℃时,B的平衡转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如下:

回答下列问题:
(1)化合物 A 中含氧官能团的名称是______。检验该官能团的化学反应方程式为______。
(2)化学反应①和④的反应类型分别为________和______。
(3)化学物B与等物质的量的Br2加成,最多生成_____种产物(不考虑顺反异构)。
(4)化合物 C 的结构简式为________。
(5)反应⑦的化学方程式为_______。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:______(不考虑立体异构)。
(7)根据该试题提供的相关信息,设计由化合物 ![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图___。
的合成路线图___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com