
【题目】3d能级上最多只能排布10个电子依据的规律是
A.洪特规则B.泡利不相容原理
C.能量最低原则和洪特规则D.能量最低原则和泡利不相容原理
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题. 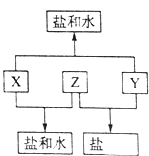
(1)D元素原子的结构示意图为;
(2)A、B、C三种元素的原子半径由小到大的顺序为(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为;
(4)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是(用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,放电时其电池反应如下:PbO2+Pb+2H2SO4== 2PbSO4+2H2O。根据此反应判断,下列叙述中正确的是
A.Pb是正极 B.PbO2得电子,被氧化
C.负极反应是Pb+SO42——2e—== PbSO4D.电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一密封体系中发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,下图是某一时间段中N2的反应速率与反应进程的曲线关系图:
2NH3(g) ΔH<0,下图是某一时间段中N2的反应速率与反应进程的曲线关系图:

回答下列问题:
(1)处于平衡状态的时间段是______、________、________。
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化:________、________、________。
(3)下列各时间段时,氨的百分含量最高的是________(填序号)。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)求t0~t1 与 t2~t3 N2的平均反应速率分别为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池型呼气酒精测试仪具有稳定性好,精度高,抗干扰性好等优点,是专门为警察设计的一款执法的检测工具,如图所示是一种酸性燃料电池酒精检测仪的示意图。下列说法错误的是( )
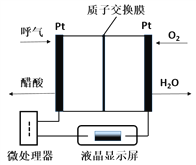
A. 该电池的负极反应式为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
B. 当电路中有0.4mol电子转移时,消耗3.2gO2
C. 电池工作时H+从右向左通过质子交换膜
D. 微处理器通过检测电流大小可计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X是周期表中半径最小的元素,Y的氧化物是形成酸雨的主要物质之一.请回答:
(1)Q元素在周期表中的位置 . J的离子的结构示意图为 .
(2)这五种元素原子半径从大到小的顺序为(填元素符号).
(3)元素的非金属性:ZQ(填“>”或“<”),下列各项中,不能说明这一结论的事实有 .
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.X2Z的稳定性比X2Q强
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与Z的单质反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2- 三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。下列说法正确的是
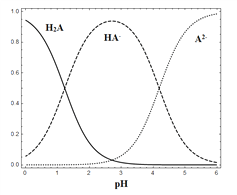
A. 在含H2A、HA-和A2- 的溶液中,加入少量NaOH固体,α(HA-)一定增大
B. 将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
C. NaHA溶液中,HA-的水解能力小于HA-的电离能力
D. 在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1:2置于恒容密闭容器中发生反应: NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH=-41.8kJ/mol,下列能说明反应达到平衡状态的是
SO3(g)+NO(g)ΔH=-41.8kJ/mol,下列能说明反应达到平衡状态的是
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. SO3和NO的体积比保持不变 D. 每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com