
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为___。
(2)已知反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为___kJ。
(3)一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
①在0~20min时段,反应速率v(N2O)为___mol·(L·min)-1。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=___。
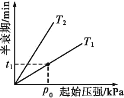
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___(填“>”“=”或“<”)T2。当温度为T1、起始压强为p0时,反应至t1min时,体系压强p=___(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g)=2I(g)(快反应)
第二步 I(g)+N2O(g)![]() N2(g)+IO(g)(慢反应)
N2(g)+IO(g)(慢反应)
第三步 IO(g)+N2O(g)![]() N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大
D.I2的浓度与N2O分解速率无关
【答案】NH4NO3![]() N2O↑+2H2O 1112.5 1.0×10-3 20.0% > 1.25p0 AC
N2O↑+2H2O 1112.5 1.0×10-3 20.0% > 1.25p0 AC
【解析】
(1)硝酸铵在催化剂下分解生成一氧化二氮和水;
(2)根据反应热=反应物的总键能-生成物的总键能进行计算;
(3)①根据v=![]() 计算速率;
计算速率;
②根据转化率=![]() ×100%进行计算;
×100%进行计算;
③其他条件相同时,温度升高化学反应速率加快,N2O分解半衰期减小;
(4)A.温度升高,化学反应速率增大;
B. 化学反应速率由反应最慢的反应决定,则第二步对总反应速率起决定作用;
C. 反应越慢活化能越大;
D. 根据含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5进行分析。
(1)硝酸铵在催化剂存在时分解生成一氧化二氮和水,反应的化学方程式为NH4NO3![]() N2O↑+2H2O;
N2O↑+2H2O;
(2)对反应2N2O(g)=2N2(g)+O2(g) ΔH=-163kJ·mol-1,设1molN2O(g)分子中化学键断裂时需要吸收的能量为x,根据反应热=反应物的键能总和-生成物的键能总和可得2x-2×945kJ-498 kJ=-163kJ,解得x=1112.5kJ;
(3)①根据表格数据,在0~20min时段,反应速率v(N2O)=1.0×10-3mol·(L·min)-1;
②由表可知,每隔10min,c(N2O)的变化量相等,单位时间内c(N2O)的变化与N2O的起始浓度无关,每10min均减小0.01mol·L-1,若N2O起始浓度c0为0.150mol·L-1,则反应至30min时转化的N2O的浓度为0.01mol·L-1×3=0.03mol·L-1,则N2O的转化率α=![]() ×100%=20.0%;
×100%=20.0%;
③其他条件相同时,温度升高化学反应速率加快,N2O分解半衰期减小,由图可知,压强相同时,对应半衰期T2>T1,则温度T1>T2;当温度为T1、起始压强为p0时,设起始时的物质的量为1 mol,则:
2N2O(g)=2N2(g)+O2(g)
起始量/mol 1 0 0
t1 min时/mol 0.5 0.5 0.25
t1 min时总物质的量为(0.5+0.5+0.25)mol=1.25mol,根据等温等容条件下,压强之比等于物质的量之比,体系压强p=p0=1.25p0;
(4)A.温度升高,化学反应速率增大,因v=k·c(N2O)·[c(I2)]0.5,则温度升高,k值增大,故A项正确;
B.化学反应速率由反应最慢的反应决定,则第二步对总反应速率起决定作用, B项错误;
C.第二步反应为慢反应,第三步反应为快反应,所以第二步活化能比第三步大, C项正确;
D.含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5,所以N2O分解速率与I2的浓度有关, D项错误;
答案选AC。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)烃A的结构简式为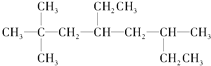 ,用系统命名法命名烃A:____________。
,用系统命名法命名烃A:____________。
(2)某烃的分子式为![]() ,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有_______种,该烃的结构简式为____________。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: ,下列各物质:A.
,下列各物质:A. 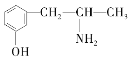 B.
B. ![]() C.
C. 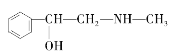 D.
D. 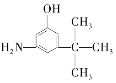 E.
E. 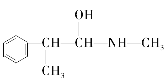
与麻黄素互为同分异构体的是_________(填字母,下同),互为同系物的是___________(填字母)。
Ⅱ.有机物C常用于食品行业。已知![]() 在足量
在足量![]() 中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重
中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重![]() 和
和![]() ,经检验剩余气体为
,经检验剩余气体为![]() 。
。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是_______。
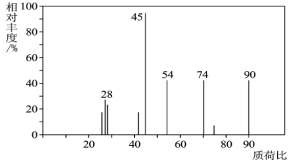
(2)C能与![]() 溶液发生反应,C一定含有的官能团是_____________。
溶液发生反应,C一定含有的官能团是_____________。
(3)C分子的核磁共振氢谱有4个峰,峰面积之比是![]() ,则C的结构简式是________。
,则C的结构简式是________。
(4)![]() 与
与![]() 的氢氧化钠溶液反应,需溶液的体积是_____
的氢氧化钠溶液反应,需溶液的体积是_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
A.2 min 末时 A 和 B 的浓度之比为 5∶3
B.x=1
C.2 min 末时 A 消耗的浓度为 0.5 mol·L-1
D.2 min 末时 B 的浓度为 1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KBr可用于光谱分析和化学分析等。
(1)制备KBr的一种方法如下:80℃时,向溶有CO(NH2)2的KOH溶液中缓慢加入Br2,至pH为6~7时反应完全,生成CO2、N2等。该反应的化学方程式为_____。
(2)KBr可用于测定苯酚(C6H5OH)样品的纯度,方法如下:取0.5000g苯酚试样,用NaOH溶液溶解后定容成250.00mL溶液;移取25.00mL该溶液,加入25.00mL0.03000molL﹣1的KBrO3(含过量KBr)标准溶液,然后加入足量盐酸,充分反应后再加足量KI溶液,充分反应;用0.1000molL﹣1Na2S2O3溶液滴定至淡黄色,加入指示剂,继续滴定至终点,用去16.20mL。测定过程中物质的转化关系如下:

①加入的指示剂为_____。
②计算苯酚样品的纯度(写出计算过程)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属与硝酸的反应,实验如下。
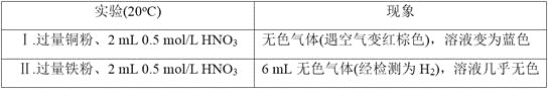
(1)Ⅰ中的无色气体是_________。
(2)Ⅱ中生成H2的离子方程式是______________________________________。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是_______________________________。
②乙同学通过分析,推测出NO3-也能被还原,依据是___________________________,进而他通过实验证实该溶液中含有NH4+,其实验操作是__________________________
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有_________________________试推测还可能有哪些因素影响_________(列举1条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
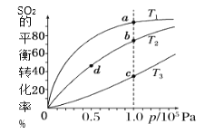
A.温度:T1温度最高
B.正反应速率:υ(a)>υ(b)=υ(d)>υ(c)
C.平均摩尔质量:M(a)<M(b)= M(d)<M(c)
D.平衡常数:K(a)>K(b)=K(d)>K(c)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com