

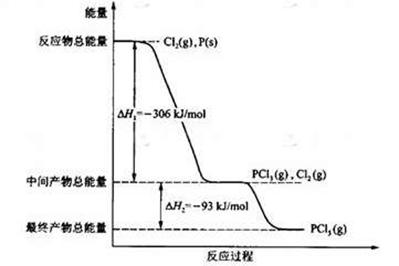
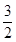 Cl2(g)=PCl3(g)△H="-306" kJ/mol
Cl2(g)=PCl3(g)△H="-306" kJ/mol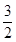 Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+
Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+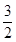 Cl2(g)=PCl3(g)△H="-306" kJ/mol。
Cl2(g)=PCl3(g)△H="-306" kJ/mol。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
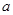 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为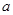 2,
2,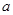 2
2 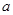 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.生石灰加水生成熟石灰 |
| B.C+H2O=CO+H2 |
| C.金属钠与水反应 |
| D.HNO3+NaOH=NaNO3+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-1780kJ/mol | B.-1220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2CH4(g) + 4O2(g) =2CO2(g) + 4H2O(l) ΔH=+890kJ·mol-1 |
| B.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=+890kJ·mol-1 |
| C.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=-890kJ·mol-1 |
| D.1/2CH4(g) + O2(g) =1/2CO2(g) + H2O(l) ΔH=-890kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.从C(石墨)=C(金刚石)ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ |
| D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图I表示向1L浓度均为0.1 mol/L的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol/L稀H2SO4溶液,产生沉淀量的变化 |
| B.图Ⅱ中逆反应的热效应△H=E1- E2 <0,所以逆反应为放热反应 |
| C.图Ⅲ表示向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,溶液pH的变化,c点溶液中:c(HCO3一)+2c(CO32一)+c(C1-)>c(Na+) |
| D.用0.1 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图Ⅳ曲线可确定HX的酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com