
 在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.
在量热计中(如图)将100mL 0.50mol?L-1的CH3COOH溶液与100mL 0.55mol?L-1的NaOH溶液混合,温度从298.0K升高至300.7K.已知量热计的热容常数(量热计各部件每升高1K所需要的热量)是150.5J?K-1,溶液密度均为1g?mL-1,生成溶液的比热容c=4.184J?(g?K)-1.| [150.5J/K+4.184J?(g?K)-1×200g]×(300.7-298)K |
| 0.05mol |


科目:高中化学 来源: 题型:
| A、阳极为纯净气体,阴、阳两极产生的气体体积比≤1:1 |
| B、阳极为纯净气体,阴、阳两极产生的气体体积比≥1:1 |
| C、阳极为混合气体,阴、阳两极产生的气体体积比≤1:1 |
| D、阳极为混合气体,阴、阳两极产生的气体体积比≥1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
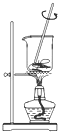 | 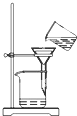 | 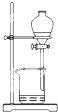 |  |
| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.萃取后放出碘的CCl4溶液 | D.分离碘并回收CCl4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
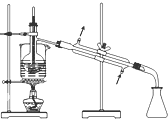
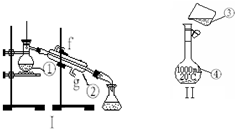 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molN2与0.3molH2在密闭容器催化剂作用下充分反应,生成氨分子数为0.2NA |
| B、标准状况下,11.2L甲醛气体中电子数为8NA |
| C、常温常压下,7.8g苯中含有单键的数目为0.9NA |
| D、1L浓度为1mol?L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子吸收光谱仪可用于测定物质中的金属元素 |
| B、质谱仪不能用于分析有机化合物的结构 |
| C、红外光谱仪可用于测定有机化合物的官能团 |
| D、氢核磁共振仪能鉴别CH3COOCH2CH3与CH3CH2COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、K=
| ||
B、K=
| ||
C、K=
| ||
D、K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②③④ |
| C、①②③④⑤ | D、①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com