
工业上焙烧明矾[ (SO4)2·12H2O]的化学方程式为:4Al(SO4)2·12H2O+3S 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4
B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-)
C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M= 474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2
NaAlO2+3Ni(OH)2
C
【解析】
试题分析:A.由反应的方程式可以看出:在焙烧明矾的反应中,S作还原剂,明矾作氧化剂,每3mol的S单质参加反应。就有6mol SO42-得到电子,所以作氧化剂的明矾的物质的量为3mol,因此还原剂与氧化剂的物质的量之比是1:1.错误。B.最后得到的K2SO4和SO2水溶液的混合物。K2SO4是强酸强碱盐,SO2水溶液H2SO3电离产生H+时溶液显酸性。错误。C.n(Al(SO4)2·12H2O)= 948 ×106g×474 g/mol=4.49×1011mol.根据方程式可知每有4mol的明矾发生反应得到的SO2完全转化为硫酸可得9mol的硫酸,若SO2的利用率为96%,硫酸的质量分数为98%则4.49×1011mol明矾反应可得硫酸的质量是4.49×1011mol×9÷4×96%×98g/mol÷98%= 432 t.正确。D.Al是原电池的负极,NiO(OH)为正极,根据电子守恒可得:该电池反应的化学方程式是Al+3NiO(OH)+NaOH +H2O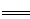 NaAlO2+3Ni(OH)2。错误。
NaAlO2+3Ni(OH)2。错误。
考点:考查焙烧明矾得到产物的应用的知识。


科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:选择题
常温时,下列叙述正确的是
A.pH=9的NH4Cl与NH3·H2O混合溶液中c(Cl-)>c(NH4+)
B.pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的1 0倍
C.AgCl在0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的溶解度相同
D.1 mL l mol l L Na2CO3溶液加水稀释至100 mL,pH和Kw均减小
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:实验题
14 分苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
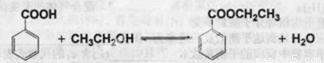
已知:
名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
已知:苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入4.0g苯甲酸,10 mL 95%的乙醇(过量),8mL 环己烷以及3 mL 浓硫酸,混合均匀并加入沸石,按右图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
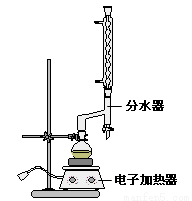
②反应一段时间,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为2.3mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①加入沸石的作用是 。如果加热一段时间后发现忘记加沸石,应该采取的正确操作是:
(3)步骤①中使用分水器不断分离除去水的目的是
(4)步骤③加入Na2CO3加入不足,在之后蒸馏时蒸馏烧瓶中可见到白烟生成,产生该现象的原因 ;
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须
(6)计算本实验的产率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市年宁城县高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是 ( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO | 稀硫酸 | 3Fe2++NO |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
C | Ba2+、HCO | 氢氧化钠溶液 | HCO |
D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
② H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g)  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:填空题
(15分)请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 。
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 。简述你的判断依据
。
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体。

(4)BCl3原子的杂化方式为 。第一电离能介于B、N之间的第二周期元素有
种。写出与BCl3结构相同的一种等电子体(写离子) 。
(5)Cu元素形成的单质,其晶体的堆积模型为______ ,D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是________ (填选项序号)。

①极性键 ②非极性键 ③配位键 ④金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C.常温下,向10mL PH=3的醋酸溶液中加水稀释后,溶液中C(CH3COO--)/C(CH3COOH) C(OH--)的值减小
D.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH)/c(NH3·H2O)的值增大
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用的说法正确的是
A.煤的干馏和石油的分馏均属化学变化 B.聚乙烯的结构简式为CH2===CH2
C.盐析可提纯蛋白质并保持其生理活性 D.石油分馏可获得乙烯、丙烯和丁二烯
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列物质不能由两种单质直接化合生成的是
A.FeS B.FeCl3 C. CuS D. Fe3O4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com