
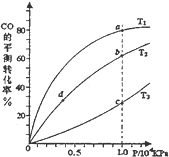
| m |
| n |
| m |
| n |
| m |
| n |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用洁净的铂丝蘸取某食盐试样在酒精灯火焰上灼烧 | 火焰显黄色 | 该食盐中不含有KIO3 |
| B | 将SO2气体通入到Ba(NO3)2溶液中 | 生成白色沉淀 | 此沉淀是BaSO3 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铅蓄电池的缺点是比能量低、笨重,废弃电池污染环境 |
| B、做衣服的棉和麻均与淀粉互为同分异构体 |
| C、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| D、煎炸食物的花生油和牛油都是可皂化的酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、人们在过渡元素中寻找工业催化剂和耐高温、耐腐蚀的合金材料 |
| B、糖类和油脂都能水解 |
| C、重金属盐中毒者可喝大量牛奶解毒 |
| D、煤的燃烧经过脱硫处理,可减少酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发皿和烧杯均可用于加热 |
| B、为减少仪器使用而带来的误差,中和热测定实验中可用温度计兼做搅拌棒 |
| C、配置1L0.1mol?L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl |
| D、测定溶液中草酸含量时,用碱式滴定管盛装KMnO4标准液进行滴定操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 NaCl溶液 |
B、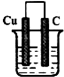 HCl溶液 |
C、 CuSO4溶液 |
D、 蔗糖溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com