
【题目】现有四种有机化合物:
甲:![]() 乙:
乙:![]() 丙:
丙:![]() 丁:
丁: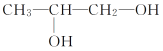
试回答:
(1)甲、乙、丁都含有的官能团的名称是________,四种物质中互为同分异构体的是________(填编号,下同)。
(2)1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是_______________。
(3)丁与醋酸在催化剂作用下发生取代反应生成的酯有__________种。
(4)①写出甲与乙醇发生酯化反应的化学方程式:_____________________。
②写出乙与新制氢氧化铜悬浊液反应的化学方程式:_______________。
【答案】羟基 乙和丙 甲 3 ![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O
+H2O ![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O
+Cu2O↓+3H2O
【解析】
(1)甲、乙、丁都含有的官能团为羟基;乙和丙的分子式都为C3H6O2,但结构不同;
(2)1mol甲与足量Na反应生成![]() molH2,1mol乙与足量Na反应生成
molH2,1mol乙与足量Na反应生成![]() molH2, 1mol丁与足量Na反应生成1molH2;
molH2, 1mol丁与足量Na反应生成1molH2;
(3)丁分子中含有2个羟基,若1mol丁与等物质的量的乙酸反应可以生成2种乙酸酯,若1mol丁与2mol乙酸反应可以生成1种乙酸酯;
(4)①在浓硫酸作用下,甲与乙醇共热发生酯化反应生成![]() 和水;
和水;
②乙含有醛基,碱性条件下,乙与新制氢氧化铜悬浊液共热反应生成![]() 、Cu2O砖红色沉淀和H2O。
、Cu2O砖红色沉淀和H2O。
(1)甲的结构简式为![]() ,官能团为羟基和羧基,乙的结构简式为
,官能团为羟基和羧基,乙的结构简式为![]() ,官能团为羟基和醛基,丁的结构简式为
,官能团为羟基和醛基,丁的结构简式为 ,官能团为羟基,则甲、乙、丁都含有的官能团为羟基;乙和丙的分子式都为C3H6O2,但结构不同,互为同分异构体,故答案为:羟基;乙和丙;
,官能团为羟基,则甲、乙、丁都含有的官能团为羟基;乙和丙的分子式都为C3H6O2,但结构不同,互为同分异构体,故答案为:羟基;乙和丙;
(2)甲分子中羟基和羧基都能与金属钠反应,1mol甲与足量Na反应生成![]() molH2,乙分子中羟基能与金属钠反应,1mol乙与足量Na反应生成
molH2,乙分子中羟基能与金属钠反应,1mol乙与足量Na反应生成![]() molH2,丁分子中羟基能与金属钠反应,1mol丁与足量Na反应生成1molH2,则生成H2最多的是甲,故答案为:甲;
molH2,丁分子中羟基能与金属钠反应,1mol丁与足量Na反应生成1molH2,则生成H2最多的是甲,故答案为:甲;
(3)丁分子中含有2个羟基,若1mol丁与等物质的量的乙酸反应可以生成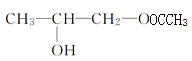 和
和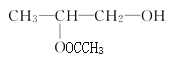 2种酯,若1mol丁与2mol乙酸反应可以生成
2种酯,若1mol丁与2mol乙酸反应可以生成 1种酯,则丁与醋酸在催化剂作用下发生取代反应生成的酯有3种,故答案为:3;
1种酯,则丁与醋酸在催化剂作用下发生取代反应生成的酯有3种,故答案为:3;
(4)①在浓硫酸作用下,甲与乙醇共热发生酯化反应生成![]() 和水,反应的化学方程式为
和水,反应的化学方程式为![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O,故答案为:
+H2O,故答案为:![]() +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O;
+H2O;
②乙含有醛基,碱性条件下,乙与新制氢氧化铜悬浊液共热反应生成![]() 、Cu2O砖红色沉淀和H2O,反应的化学方程式为
、Cu2O砖红色沉淀和H2O,反应的化学方程式为![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O,故答案为:
+Cu2O↓+3H2O,故答案为:![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。


科目:高中化学 来源: 题型:
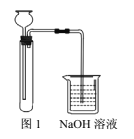
【题目】某化学实验小组拟探究改进Fe(OH)2的制取方法。
方案1:
①实验药品:FeS固体、稀硫酸溶液、NaHCO3溶液;
②实验装置如图1。
方案2:
①取一只试管,向其中加入一粒NaOH固体,再加入约2mL新制的FeSO4溶液;
②将试管置于酒精灯火焰上,对着有NaOH颗粒的部位小心加热(不能使液体剧烈沸腾)。使沉淀自下至上慢慢增多,观察下部沉淀颜色。
方案3:
①先在试管中滴入2~3 mL液体石蜡;
②用胶头滴管小心往试管底部注入4~5 mL新制的FeSO4溶液;
③再往试管中投入1粒绿豆大小的金属钠,观察反应现象。
回答下列问题:
(1)“方案1”中,后加入试管中的液体是______,NaOH溶液的作用是_______。
(2)“方案2”中,对着有NaOH颗粒的部位小心加热的目的是________。
(3)“方案2”的沉淀中,上层沉淀的颜色是________,下层沉淀的颜色是________,发生此现象的原因是________。
(4)“方案3”中反应的化学反应方程式为________。
(5)“方案3”的实验过程中间断性的出现白色沉淀,其原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
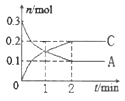
A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g) H=-196kJ·moL1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1·min1
B. 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C. 该温度,反应的平衡常数为11.25L·mol-1
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置示意图如图所示:
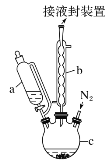
已知:Ⅰ.二茂铁熔点是173 ℃,在100℃时开始升华;沸点是249℃。
Ⅱ.制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入25 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10 min;
②再从仪器a滴入5.5 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g·cm-3),搅拌;
③将6.5 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器c的名称是______。和普通分液漏斗相比,使用恒压滴液漏斗a的优点是______。
(2)步骤①中通入氮气的作用是_________。
(3)步骤⑤用盐酸洗涤的目的是_________。
(4)步骤⑦是二茂铁粗产品的提纯,该过程在如图装置中进行,其操作名称为__________;为了确认得到的是二茂铁,还需要进行的一项简单实验是__________;
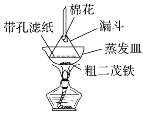
(5)若最终制得纯净的二茂铁4.3 g,则该实验的产率为________(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,向A、B中均充入1mol X、l mol Y,起始时A、B的体积都等于1L。在同温、同压和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:X(g)+Y(g) ![]() 2Z(g)+W(g) ΔH <0,达平衡时,A的体积为1.4L。下列说法错误的是( )
2Z(g)+W(g) ΔH <0,达平衡时,A的体积为1.4L。下列说法错误的是( )

A. 两容器中的反应分别达到平衡时,反应物X的速率:v(B)>v(A)
B. A容器中X的转化率为80%
C. 平衡时两容器的压强:PA<PB
D. 平衡时Y的体积分数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
A.保持容器体积不变,增加C的物质的量,反应速率增大
B.保持容器体积不变,充入N2容器内气体压强增大,化学反应速率增大
C.保持压强不变,充入N2容器内气体压强不变,化学反应速率减小
D.保持容器体积不变,随着反应进行气体物质的量增多,压强增大,反应速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是
已知:K(HY)=5.0×10-11

A. 可选取酚酞作为滴定指示剂 B. M点溶液的pH>7
C. 图中Q点水的电离程度最小,Kw<10-14 D. M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com