
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是
已知:K(HY)=5.0×10-11

A. 可选取酚酞作为滴定指示剂 B. M点溶液的pH>7
C. 图中Q点水的电离程度最小,Kw<10-14 D. M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K= ![]() .该温度下在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是( )
.该温度下在体积均为10L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是( )
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2)是0.08 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某再回收利用公司对一厨房铁铝合金废旧家具进行回收利用,其流程如下图所示:
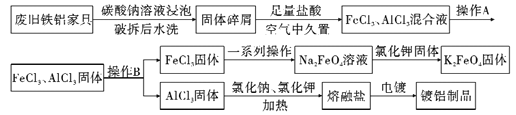
请回答下列问题:
(1)流程中加碳酸钠溶液浸泡的目的是_______________;在空气中久置的目的是_________________。
(2)同条件下Na2FeO4溶解度__________K2FeO4溶解度(填“低于”,“高于”, “不确定”),推测K2FeO4在净水方面的作用_______________。(至少答两条)
(3)已知K2FeO4水解显碱性。在洗涤K2FeO4固体时最好选用__________。
A.水 B.亚硫酸氢钠溶液 C.氢氧化钠溶液 D.先氢氧化钠溶液后乙醇
(4)熔融盐电镀中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电镀的主要电极反应式为___________________。(写出一个电极反应即可)
(5)已知氯化铝受热易升华,气态氯化铝的密度为11.92g/L(已转化为标准状况),则气态氯化铝的分子式为______________________。
(6)氢氧化铝经常用于做药品,有两种溶解方式:可以溶解为Al3+或[Al(OH)4]-。已知25℃时氢氧化铝在pH=3和pH=10的两溶液中溶解度均为7.8×10-3g(溶液密度近似为1g/mL),则25℃下氢氧化铝的两种溶解方式的溶度积之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是( )
A.一定有氧元素参加
B.氧化反应一定先于还原反应发生
C.氧化剂本身发生氧化反应
D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1moLL﹣1NaOH溶液,消耗NaOH溶液体积(X轴)和生成沉淀(Y轴)之间的函数关系如图所示,则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为( )
A.1:1:1
B.2:2:1
C.2:1:1
D.1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在人们的日常生活、生产和环保事业中属于“明星物质”。回答下列问题:
(1)氨气是农业肥料和化工生产的重要原料,其电子式为____。
(2)叠氮化钠(NaN3)在药物制备、合成影像、化学分析、汽车制造等行业有着广泛的用途,但该物质极易爆炸,且有副毒。可用NaClO溶液对含有叠氮化钠的溶液进行处理,生成一种无污染的气体单质,反应的化学方程式为______________。
(3)“固氮”是农业科学家研究的永恒主题。在某特殊催化剂和光照条件下,N2与水反应可生成NH3。
已知:
(i)4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
2N2(g) +6H2O(g) △H1=-1266 kJ/mol;
(ii)H2O(g)=H2O(l) △H2= -44.0kJ/mol。
则2N2(g) +6H2O(l)![]() 4NH3(g)+3O2(g) △H3=______kJ/mol。
4NH3(g)+3O2(g) △H3=______kJ/mol。
(4)目前“人工固氮”最成功的应用就是工业合成氨:
N2(g) +3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。
2NH3(g) △H=-92.4kJ/mol。将1.00molN2和3.00molH2充入到容积为3L的恒容密闭容器中,发生上述反应。

①图甲是测得X、Y 的浓度随时间变化的曲线.其中Y 为_____(写化学式),反应达到平衡时的平均反应速率v(N2) =_________。
②在不同温度和压强下,平衡体系中NH3的体积分数与温度、压强关系如图乙,则压强p1_____p2(填“>”“<”“=”或“不确定”,下同),B、D 两点的平衡常数KB____KD,B 点N2 的转化率=_________(保留3位有效数字)。
(5)“绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3=7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图丙:

负极反应式为__________,当有标准状况下4.48 L NO2被处理时,转移电子的物质的量为_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com