
用石墨作电极电解![]() 的稀硫酸溶液50 mL,通电1h停止电解,此时测得溶液的
的稀硫酸溶液50 mL,通电1h停止电解,此时测得溶液的![]() ,已知每个电子所带电量为
,已知每个电子所带电量为![]() ,则下列说法正确的是
,则下列说法正确的是
[ ]
A.电源的电压为36V
B.阴、阳两极共产生168L气体(标准状况)
C.电路中的电流强度约为134A
D.溶液的质量减少15g
科目:高中化学 来源: 题型:
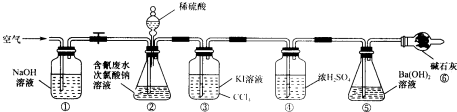
| 实验 | c(H2SO4)mol.L-1 | V(H2SO4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | 100 | 100 | ||
| 2 | 0.0500 | 100 | 100 | |
| 3 | 0.2000 | 100 | 100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.向氢氧化钠溶液中通入过量CO2:2OH-+CO2====![]() +H2O
+H2O
B.硫酸铝溶液中加入过量氨水:Al3++4 NH3·H2O====![]() +4
+4![]() +2H2O
+2H2O
C.用石墨作电极电解饱和食盐水:2Cl-+2H2O![]() 2 OH-+H2↑+Cl2↑
2 OH-+H2↑+Cl2↑
D.氢氧化亚铁溶于足量稀硝酸:Fe(OH)2+2H+====Fe2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com