
按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是 ( )
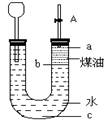
A.打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
科目:高中化学 来源: 题型:阅读理解
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:
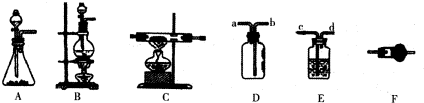
 如图所示装置,在化学实验中十分常见,它可以作为制取气体、收集气体、性质验证、安全防护等多种作用,按要求回答相关问题:
如图所示装置,在化学实验中十分常见,它可以作为制取气体、收集气体、性质验证、安全防护等多种作用,按要求回答相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
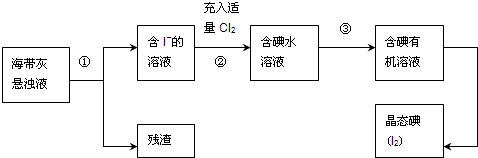
查看答案和解析>>
科目:高中化学 来源: 题型:
(08广东实验中学三模)(11分)某课外活动小组用蜡烛通过下列装置进行实验。实验完毕后,他们写成了下面的实验报告,请你协助他们完成。

⑴ 实验目的: 。
⑵ 实验装置与药品:装置如上图;药品有蜡烛、 、 。
⑶ 实验步骤:
① 分别称量装置Ⅱ(含药品)的质量 m1 和装置Ⅲ(含药品)的质量 m2。
② 按如图所示的装置连接好仪器,并将蜡烛放置在装置中倒置漏斗的下方。
③ 点燃蜡烛,打开自来水龙头抽吸蜡烛燃烧产生的气体(热的混和气体分别在装置Ⅱ、Ⅲ中被吸收)。
④ 蜡烛燃烧大约 5min 后,熄灭蜡烛,待装置Ⅱ和Ⅲ ___________后,分别称得质量为m3、m4。
⑤ 采用相同的时间但不点燃蜡烛的情况下重复上述实验。
⑥ 计算:蜡烛中碳、氢元素原子物质的量之比的数学表达式为:____________(取用①、④中的数据)。
⑷ 几点说明:
① 将实验装置中的Ⅱ、Ⅲ对调,并分别装入用无水CuSO4和澄清石灰水,该装置又可用于定性检测 。
② 步骤⑤的目的是 。
③ 装置Ⅳ是与自来水龙头相接即成一种抽气装置,控制装置Ⅳ中自来水的进水速度可以调节抽气速度。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com