
 Na2CO3+CO2↑+H2O 固体质量差值
Na2CO3+CO2↑+H2O 固体质量差值 =42g,
=42g, =42%;
=42%;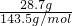 =0.2mol,根据氯离子守恒,原混合物中n(NaCl)=n(AgCl)=0.2mol,
=0.2mol,根据氯离子守恒,原混合物中n(NaCl)=n(AgCl)=0.2mol, =11.7%,
=11.7%, Na2CO3+CO2↑+H2O,导致固体质量减少,根据固体质量减少,利用差量法计算原混合物中碳酸氢钠的质量.最后剩余沉淀的质量为28.7g为AgCl,根据n=
Na2CO3+CO2↑+H2O,导致固体质量减少,根据固体质量减少,利用差量法计算原混合物中碳酸氢钠的质量.最后剩余沉淀的质量为28.7g为AgCl,根据n= 计算AgCl的物质的量,根据氯离子守恒计算原混合物中n(NaCl),再根据m=nM计算氯化钠的质量,进而计算各物质的量的质量分数.
计算AgCl的物质的量,根据氯离子守恒计算原混合物中n(NaCl),再根据m=nM计算氯化钠的质量,进而计算各物质的量的质量分数.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012年广西省高一上学期段考化学试卷 题型:计算题
(6分)现有Na2CO3和NaHCO3的混合物13.7g,用过量的盐酸处理,共收集到气体6.6g,求混合物中NaHCO3的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com