
【题目】科学家最近在﹣100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( ) 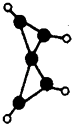
A.X能使溴的四氯化碳溶液褪色
B.X是一种在常温下能稳定存在的液态烃
C.X分子中在同一平面上的碳原子最多5个
D.充分燃烧等质量的X和甲烷,X消耗氧气多
科目:高中化学 来源: 题型:
【题目】(1)为消除氮氧化物(NOx)的污染,可采用甲烷催化还原法:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867kJ/mol
则△H2=_________。
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。
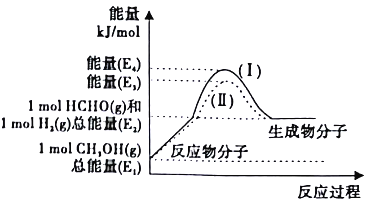
①写出上述反应的热化学方程式______________。
②反应热大小比较:过程I______过程II(填“大于”、“小于”或“等于”)。
③上述反应过程中,需向体系中通入适量空气,控制条件消耗体系中的H2,既提高甲醛产率,同时使反应温度保持不变,则理论上n(CH3OH):n(空气)=________。(已知:H2(g)+![]() O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
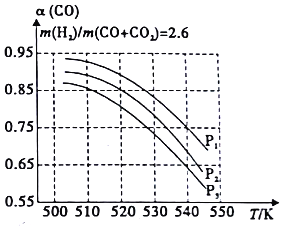
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。图中的压强由大到小顺序为_____,判断理由是_____________;试解释CO平衡转化率随温度升高面减小的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
弱酸 | CH3COOH | H2CO3 | HNO2 |
电离常数(25℃) | K=1.8×10﹣5 | K=4.3×10﹣7 | K=5.0×10﹣4 |
请回答下列问题:
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH﹣)c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3 , 所得混合液的pH=6,则混合液中 ![]() = .
= .
(3)常温下,将20mL 0.1molL﹣1 CH3COOH溶液和20mL0.1molL﹣1HNO2溶液分别与20mL 0.1 molL﹣1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是(填写序号);反应结束后所得两溶液中,c(CH3COO﹣) c(NO2﹣)(填“>”、“<”或“=”);
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3H2O的电离常数Kb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体和蒸馏水准确配制一定物质的量浓度的NaOH溶液.以下仪器中,不需要用到的是( )
A.烧杯
B.玻璃棒
C.容量瓶
D.蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
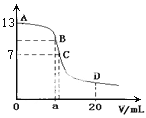
A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA
C.NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA
D.lmolFe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜~锌原电池,电解质溶液为稀硫酸,当该原电池工作时( )
A.铜电极上发生氧化反应
B.铜电极上发生还原反应
C.电子从铜极经过外电路流向锌极
D.电解质溶液中H+浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下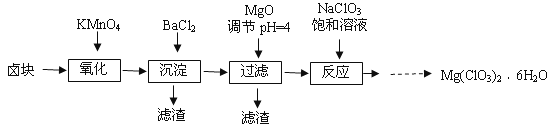
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
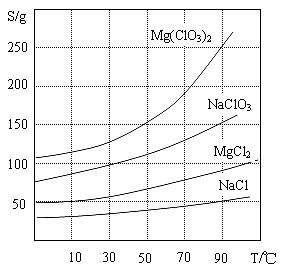
(1)过滤所需要的主要玻璃仪器有 ,
(2)加入BaCl2的目的是 ,加MgO后过滤所得滤渣的主要成分为 。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶;② ;洗涤;③将滤液冷却结晶;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299g/mol)
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7 溶液滴定剩余的Fe2+至终点。反应的方程式为: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7 溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: ;
② 产品中Mg(ClO3)2·6H2O的质量分数为 。(保留到小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com