
����Ŀ��(1)Ϊ������������(NOx)����Ⱦ���ɲ��ü������ԭ��:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H3=-867kJ/mol
���H2=_________��
(2)�״���������Ƶ���Ҫ�Ļ�����Ʒ������ȩ���Ʊ�������������ת����ϵ��ͼ��ʾ��
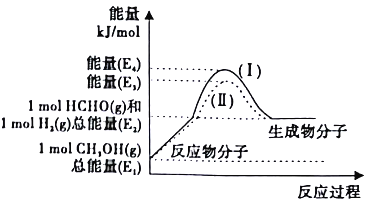
��д��������Ӧ���Ȼ�ѧ����ʽ______________��
�ڷ�Ӧ�ȴ�С�Ƚ�:����I______����II������ڡ�����С�ڡ����ڡ�����
��������Ӧ������,������ϵ��ͨ��������������������������ϵ�е�H2�������ȩ���ʣ�ͬʱʹ��Ӧ�¶ȱ��ֲ��䣬��������n(CH3OH)��n(����)=________������֪:H2(g)+![]() O2(g)==H2O(g) ��H=-akJ/mol��������O2���������Ϊ0.2)
O2(g)==H2O(g) ��H=-akJ/mol��������O2���������Ϊ0.2)
(3)��ҵ�ϳ���CO��CO2��H2�ϳɼ״�ȼ�ϣ���ԭ��Ϊ:
��CO(g)+2H2(g)![]() CH3OH(g) ��H<0
CH3OH(g) ��H<0
��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H>0
CO(g)+H2O(g) ��H>0
������������ɹ̶�ʱ��COƽ��ת����(��)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��ͼ�е�ѹǿ�ɴ�С˳��Ϊ_____���ж�������_____________���Խ���COƽ��ת�������¶��������С��ԭ����__________________��
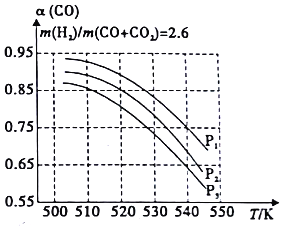
���𰸡� -1160kJ/mol CH3OH(g)==HCHO(g)+H2(g) ��H=+(E2-E1)kJ/mol ���� ![]() P1>P2>P3 ��ͬ�¶��£����ڷ�Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ����������CO��ת���ʣ�����Ӧ��Ϊ�������������ķ�Ӧ������CO��������ѹǿӰ�죬������ѹǿʱ��������CO��ת�������� �����¶�ʱ����Ӧ��Ϊ���ȷ�Ӧ��ƽ���������ƶ���ʹ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ��ƽ�������ƶ����ֲ���CO���������ܽ�������¶����ߣ�ʹCO��ת���ʽ���
P1>P2>P3 ��ͬ�¶��£����ڷ�Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ����������CO��ת���ʣ�����Ӧ��Ϊ�������������ķ�Ӧ������CO��������ѹǿӰ�죬������ѹǿʱ��������CO��ת�������� �����¶�ʱ����Ӧ��Ϊ���ȷ�Ӧ��ƽ���������ƶ���ʹ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ��ƽ�������ƶ����ֲ���CO���������ܽ�������¶����ߣ�ʹCO��ת���ʽ���
��������(1)��֪����CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H1=-574kJ/mol
![]() CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H3=-867kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H3=-867kJ/mol
���ݸ�˹���ɣ��ɢۡ�2-�ٵ÷�ӦCH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)���H2=��H3��2-��H1=-867kJ/mol��2-��-574kJ/mol��= -1160kJ/mol��
��2���ٸ���ͼ����Ϣ��֪��������Ӧ���Ȼ�ѧ����ʽΪ��CH3OH(g)==HCHO(g)+H2(g) ��H=+(E2-E1)kJ/mol���ڴ����ı仯ѧ��Ӧ�Ļ�ܣ������ܸı䷴Ӧ���ʱ䣬�ʷ�Ӧ�ȴ�С�Ƚ�:����I���ڹ���II��
�� CH3OH(g)===HCHO(g)��H2(g) ��H��+(E2��E1) kJ/mol
1 mol (E2��E1) kJ
n(CH3OH) mol n(CH3OH)(E2��E1) kJ
H2(g)��![]() O2(g)===H2O(g) ��H����a kJ/mol
O2(g)===H2O(g) ��H����a kJ/mol
0��5 mol a kJ
n(O2) mol 2an(O2) kJ
��n(CH3OH)(E2��E1)��2an(O2)����n(CH3OH)��n(O2)��![]() ��
��
��n(CH3OH)��n(����)��![]() ��
��
��3����ͬ�¶��£����ڷ�Ӧ��Ϊ�����������С�ķ�Ӧ����ѹ����������CO��ת���ʣ�����Ӧ��Ϊ�������������ķ�Ӧ������CO��������ѹǿӰ�죬������ѹǿʱ��������CO��ת�������ߣ�����ͼ�е�ѹǿ�ɴ�СΪP1��P2��P3����Ӧ��Ϊ���ȷ�Ӧ�������¶�ʱ��ƽ�������ƶ���ʹ����ϵ��CO��������Ӧ��Ϊ���ȷ�Ӧ��ƽ�������ƶ����ֲ���CO�����������ս�������¶����ߣ�ʹCO��ת���ʽ��͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017���Ĵ���կ����8.8�������¶���������,LΪ���������˵�ҩ��,�ϳ�L����·���£�
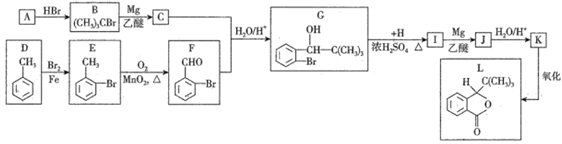
��֪����F�ܷ���������Ӧ;
��R-Br+Mg![]() RMgBr�������Լ���,�����Լ������ʻ�������Ӧ,�磺R'-CHO+RMgBr��
RMgBr�������Լ���,�����Լ������ʻ�������Ӧ,�磺R'-CHO+RMgBr��![]() +Mg(OH��Br��
+Mg(OH��Br��
��ش��������⣺
��1����A�Ļ�ѧ����Ϊ________________��
��2��C+F��G������Ӧ����������Ϊ_________��_________��
��3��H�Ľṹ��ʽ��_____________,L�ķ���ʽΪ______________��
��4��D��E�Ļ�ѧ��Ӧ����ʽΪ_________________________________��
��5��1molI�������л�����������NaOH��Ӧ,����NaOH�����ʵ���Ϊ_________ mol��
��6��XΪG��ͬ���칹��,��������������
����FeCl3��Һ����ɫ����������ֱ�����ڱ����Ϣ۱����ϵ�һ�ȴ���ֻ��1�����к˴Ź�������Ϊ4����X�Ľṹ��ʽΪ_________��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.�Ҵ���ˮ���ܵ����������H���������Ҵ��ǵ����
B.�Ҵ���O2��������ȫȼ��������ȩ
C.�Ҵ����������е���ԭ�Ӷ��ɱ����û�����
D.�Ҵ���һ�ֺܺõ��ܼ������ܽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ѧ��������ȫ��ͬ���ǣ�������
A.SO2��NaOH
B.CO2��H2O
C.Cl2��HCl
D.CCl4��NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص������Լ���ǩ�ϵIJ������ݡ��ݴ�����˵������������ ��
���ữѧ��(CP)
(500mL)
Ʒ��������
��ѧʽ��H2SO4
��Է���������98
�ܶȣ�1.84g/cm3
����������98%
A. �������Լ������ʵ���Ũ��Ϊ18.4mol��L-1
B. ��������������ˮ���������Һ��������������49%
C. ����200mL 4.6mol��L-1��ϡ������ȡ������62.5mL
D. ������,��2.7gAlͶ�������������пɵõ���״���µ�����3.36L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����н�ʢ�м����������Ļ���������Ͳ������ʢ�б���ʳ��ˮ��ˮ���У�����ʹ�䷢����Ӧ������˵��������ǣ� ��

A. ͨ����Ͳ�ڱ��ϳ��ֵ���״Һ�ο���˵�����������л�����
B. �Ȼ��⼫������ˮ��������Ͳ��Һ������
C. ����ʳ��ˮ�ܹ������������ܽ�
D. ��Ͳ��������ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ũ�����Ũ�������������ȷ����
A.�����¶�������������������
B.¶���ڿ����У���������Һ������������
C.�����¶�����ͭ�Ͽ췴Ӧ
D.¶���ڿ����У���������Һ��Ũ�ȶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������ʱ仯�ıȽϣ�����ȷ���ǣ�������
A.����ǿ����H2SiO4��H2CO3��H3PO4
B.ԭ�Ӱ뾶��С��Na��S��O
C.����ǿ����KOH��NaOH��LiOH
D.��ԭ��ǿ����F����Cl����I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ک�100��ĵ����ºϳ�һ����X���˷��ӵ�ģ����ͼ��ͼ�е����߱�ʾ��ѧ����������˵����ȷ���ǣ� �� 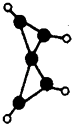
A.X��ʹ������Ȼ�̼��Һ��ɫ
B.X��һ���ڳ��������ȶ����ڵ�Һ̬��
C.X��������ͬһƽ���ϵ�̼ԭ�����5��
D.���ȼ�յ�������X�ͼ��飬X����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com