
【题目】下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:H2SiO4<H2CO3<H3PO4
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F﹣>Cl﹣>I﹣
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油分馏可获得乙烯、丙烯和丁二烯
B.将重油经过裂化可以得到汽油
C.将石油裂解制得乙烯等化工原料
D.石油裂化的目的是提高汽油等轻质燃料的产量和质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为消除氮氧化物(NOx)的污染,可采用甲烷催化还原法:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867kJ/mol
则△H2=_________。
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。
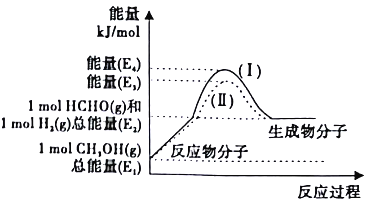
①写出上述反应的热化学方程式______________。
②反应热大小比较:过程I______过程II(填“大于”、“小于”或“等于”)。
③上述反应过程中,需向体系中通入适量空气,控制条件消耗体系中的H2,既提高甲醛产率,同时使反应温度保持不变,则理论上n(CH3OH):n(空气)=________。(已知:H2(g)+![]() O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
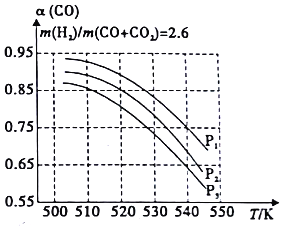
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。图中的压强由大到小顺序为_____,判断理由是_____________;试解释CO平衡转化率随温度升高面减小的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达到平衡时: ![]() =
= ![]()
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.MnS(s)的浊液中加入少量可溶性MnSO4固体后,c(S2﹣)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、E为金属单质,B是淡黄色粉末且常用于防毒面具中,回答下题。
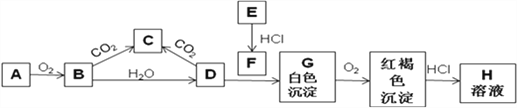
(1)实验室中A常常保存在盛放__________的广口瓶中。
(2)写出B转变成C的化学方程式_______________________。0.1molB参与该反应,转移电子的个数为_________ 。
(3)用化学方程式表示沉淀G颜色发生变化的原因:____________________________________________。
(4)从A、B、C、D、E、G、H选出试剂可制备F,写出对应离子方程式:______________________________________;
(5)直接向F溶液中加入B固体,写出可能出现的现象:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
弱酸 | CH3COOH | H2CO3 | HNO2 |
电离常数(25℃) | K=1.8×10﹣5 | K=4.3×10﹣7 | K=5.0×10﹣4 |
请回答下列问题:
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH﹣)c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3 , 所得混合液的pH=6,则混合液中 ![]() = .
= .
(3)常温下,将20mL 0.1molL﹣1 CH3COOH溶液和20mL0.1molL﹣1HNO2溶液分别与20mL 0.1 molL﹣1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是(填写序号);反应结束后所得两溶液中,c(CH3COO﹣) c(NO2﹣)(填“>”、“<”或“=”);
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3H2O的电离常数Kb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜~锌原电池,电解质溶液为稀硫酸,当该原电池工作时( )
A.铜电极上发生氧化反应
B.铜电极上发生还原反应
C.电子从铜极经过外电路流向锌极
D.电解质溶液中H+浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com