
【题目】下列各组物质中,化学键类型完全相同的是( )
A.SO2和NaOH
B.CO2和H2O
C.Cl2和HCl
D.CCl4和NaCl
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)主要用于棉纺、亚麻、腈纶、涤纶等纤维漂白(不适于羊毛、绢丝、粘胶丝、尼龙等),也可用于食品、饮用水消毒、纸张漂白和鱼药制造。工业上常用电解法生产亚氯酸钠(NaClO2),请根据下面的工艺流程图回答下列问题:

已知:纯的ClO2易分解爆炸。一般用稀有气体或空气稀释到10%以下安全。
(1)电解饱和NaCl溶液之前须除去其中的Ca2+、Mg2+、SO42-等杂质,依次加入BaCl2溶液、Na2CO3溶液、NaOH溶液,充分反应后将沉淀一并滤去,若经检测发现滤液中SO42-的浓度仍大于10-5mol·L -1,其可能的原因为____________________,滤液中c(CO32-)∶c(SO42-)为____________。[已知:Ksp(BaSO4 )= 1.0×10 -10,Ksp(BaCO3 )= 5.0×10-9 ]
(2)无隔膜电解槽内发生的反应中氧化产物、还原产物的物质的量之比为____________。
(3)将制得的ClO2 通入电解槽的阴极室,饱和NaCl溶液通入电解槽的阳极室,通电一段时间后可得到产品,电解时阴极的电极反应式为_____________________________。
(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,反应的离子方程式为______________。
(5)ClO2溶液的浓度含量可用碘量法测定,其原理为在盐酸介质中ClO2与I-发生反应:2ClO2+8H++10I-=2Cl-+5I2+4H2O,再用Na2S2O3标准液滴定生成的I2,通过计算即可确定ClO2溶液浓度含量。已知:I2+2Na2S2O3=2NaI+Na2S4O6。
①滴定过程中需要滴加的指示剂为____________。
②取V1 mL的ClO2溶液加入到适量的盐酸和KI溶液中,反应完毕后再用0.lmol·L-1 的Na2S2O3溶液滴定反应后的溶液,若消耗了V2mL的Na2S2O3溶液,则ClO2 的浓度为____________ g·L-1。(杂质不参与反应,ClO2 的还原产物为Cl- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油分馏可获得乙烯、丙烯和丁二烯
B.将重油经过裂化可以得到汽油
C.将石油裂解制得乙烯等化工原料
D.石油裂化的目的是提高汽油等轻质燃料的产量和质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液电解后通人ClO2,能得到一种高效漂白剂和氧化剂NaClO2。某同学在实验室中对此反应进行了探究。回答下列问题:
(1)配制一定物质的量浓度的NaCl溶液,除容量瓶、玻璃棒、量筒、烧杯外,还需要的玻璃仪器是_________(填名称)。
(2)ClO2是一种易溶于水而难溶于有机溶剂的气体,用亚氯酸钠固体与纯净的氯气反应可制取,反应为2NaClO2+Cl2=2ClO2+2NaCl。下图是实验室用于制备并收集一定量纯净ClO2 的装置,其连按顺序为:a→__________(按气流方向,用小写字母表示),E 装置的作用是________。

(3)探究NaClO2的氧化性及测定其纯度时进行了如下实验:
实验目的 | 操作步骤 | 现象或原因 |
1.证明NaClO2具有氧化性 | 取一定量的样品,用H2SO4酸化,再加入适量_____和KSCN 溶液检验 | 溶液显红色 |
2.测定NaClO2的纯度 | ①准确称一定质量的样品,在酸性条件下加入适量蒸馏水和足量的KI晶体 | 致溶液显黄色的离子方程式____________。 |
②取25.00mL上述待测溶液,加入________溶液做指示剂 | 反应的离子方程式:I2+2S2O32-=2I- +S4O62- | |
③用一定浓度的Na2S2O3 标准液滴定,当滴入最后一滴标准溶液时,反应达到滴定终点 | __________(用文字描述现象) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1molL﹣1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01molL﹣1的下列五种物质的溶液中,酸性最强的是;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×10﹣9 . 现将浓度为2×10﹣4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关1mol O2的说法中,不正确的是(NA表示阿伏伽德罗常数)( )
A.质量为32g
B.含氧原子数为NA
C.含氧分子数为NA
D.在标准状况下,体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为消除氮氧化物(NOx)的污染,可采用甲烷催化还原法:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867kJ/mol
则△H2=_________。
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。
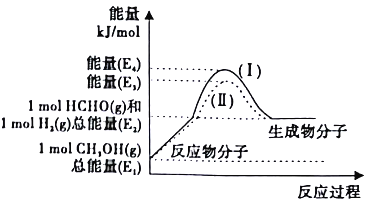
①写出上述反应的热化学方程式______________。
②反应热大小比较:过程I______过程II(填“大于”、“小于”或“等于”)。
③上述反应过程中,需向体系中通入适量空气,控制条件消耗体系中的H2,既提高甲醛产率,同时使反应温度保持不变,则理论上n(CH3OH):n(空气)=________。(已知:H2(g)+![]() O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
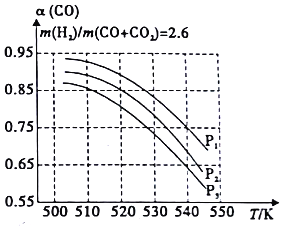
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。图中的压强由大到小顺序为_____,判断理由是_____________;试解释CO平衡转化率随温度升高面减小的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达到平衡时: ![]() =
= ![]()
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.MnS(s)的浊液中加入少量可溶性MnSO4固体后,c(S2﹣)变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com