
【题目】亚氯酸钠(NaClO2)主要用于棉纺、亚麻、腈纶、涤纶等纤维漂白(不适于羊毛、绢丝、粘胶丝、尼龙等),也可用于食品、饮用水消毒、纸张漂白和鱼药制造。工业上常用电解法生产亚氯酸钠(NaClO2),请根据下面的工艺流程图回答下列问题:

已知:纯的ClO2易分解爆炸。一般用稀有气体或空气稀释到10%以下安全。
(1)电解饱和NaCl溶液之前须除去其中的Ca2+、Mg2+、SO42-等杂质,依次加入BaCl2溶液、Na2CO3溶液、NaOH溶液,充分反应后将沉淀一并滤去,若经检测发现滤液中SO42-的浓度仍大于10-5mol·L -1,其可能的原因为____________________,滤液中c(CO32-)∶c(SO42-)为____________。[已知:Ksp(BaSO4 )= 1.0×10 -10,Ksp(BaCO3 )= 5.0×10-9 ]
(2)无隔膜电解槽内发生的反应中氧化产物、还原产物的物质的量之比为____________。
(3)将制得的ClO2 通入电解槽的阴极室,饱和NaCl溶液通入电解槽的阳极室,通电一段时间后可得到产品,电解时阴极的电极反应式为_____________________________。
(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,反应的离子方程式为______________。
(5)ClO2溶液的浓度含量可用碘量法测定,其原理为在盐酸介质中ClO2与I-发生反应:2ClO2+8H++10I-=2Cl-+5I2+4H2O,再用Na2S2O3标准液滴定生成的I2,通过计算即可确定ClO2溶液浓度含量。已知:I2+2Na2S2O3=2NaI+Na2S4O6。
①滴定过程中需要滴加的指示剂为____________。
②取V1 mL的ClO2溶液加入到适量的盐酸和KI溶液中,反应完毕后再用0.lmol·L-1 的Na2S2O3溶液滴定反应后的溶液,若消耗了V2mL的Na2S2O3溶液,则ClO2 的浓度为____________ g·L-1。(杂质不参与反应,ClO2 的还原产物为Cl- )
【答案】 加入过量的Na2CO3溶液时,BaSO4(s)会分转化为BaCO3(s) ,从而释放出SO42- 50∶1 1∶3 ClO2+e-=ClO2- 2ClO2+ 2CN-=2CO2+N2+2Cl- 淀粉溶液 ![]()
【解析】(1)沉淀转化的方程式:BaSO4(s) +CO32-![]() BaCO3(s)+SO42-,平衡常数为c(SO42-)∶c(CO32-)=Ksp(BaSO4 ):Ksp(BaCO3 )= 1.0×10 -10:5.0×10-9=1:50,滤液中c(CO32-)∶c(SO42-)为50:1,在溶液中加入过量的Na2CO3溶液时,BaSO4(s)会分转化为BaCO3(s) ,从而释放出SO42-,导致滤液中SO42-的浓度仍大于10-5mol·L -1;(2)NaCl+3H2O
BaCO3(s)+SO42-,平衡常数为c(SO42-)∶c(CO32-)=Ksp(BaSO4 ):Ksp(BaCO3 )= 1.0×10 -10:5.0×10-9=1:50,滤液中c(CO32-)∶c(SO42-)为50:1,在溶液中加入过量的Na2CO3溶液时,BaSO4(s)会分转化为BaCO3(s) ,从而释放出SO42-,导致滤液中SO42-的浓度仍大于10-5mol·L -1;(2)NaCl+3H2O![]() NaClO3+3H2↑,无隔膜电解槽内发生的反应中氧化产物NaClO3、还原产物H2的物质的量之比为1∶3 ;(3)将制得的ClO2 通入阴极室,在阴极得电子制得亚氯酸盐,ClO2+e-=ClO2-;(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,产物为二氧化碳和氮气,反应的离子方程式为2ClO2+ 2CN-=2CO2+N2+2Cl- ;(5)碘单质遇到淀粉呈蓝色,①滴定过程中需要滴加的指示剂为淀粉溶液;②由2ClO2+8H++10I-=2Cl-+5I2+4H2O,和I2+2Na2S2O3=2NaI+Na2S4O6得
NaClO3+3H2↑,无隔膜电解槽内发生的反应中氧化产物NaClO3、还原产物H2的物质的量之比为1∶3 ;(3)将制得的ClO2 通入阴极室,在阴极得电子制得亚氯酸盐,ClO2+e-=ClO2-;(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,产物为二氧化碳和氮气,反应的离子方程式为2ClO2+ 2CN-=2CO2+N2+2Cl- ;(5)碘单质遇到淀粉呈蓝色,①滴定过程中需要滴加的指示剂为淀粉溶液;②由2ClO2+8H++10I-=2Cl-+5I2+4H2O,和I2+2Na2S2O3=2NaI+Na2S4O6得
关系式:2ClO2~5I2~10Na2S2O3,
135g 10mol
m 0.lmol·L-1×V2mL
![]() ,
,
V1mL的ClO2溶液ClO2的浓度为![]()


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
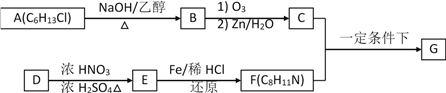
已知以下信息:
①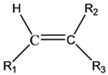
![]()
![]()
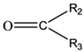
②1 mol B经上述反应可生成2 mol C,且C不能发生银镜反应。
③D属于单取代芳烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤![]()
回答下列问题:
(1)由A生成B的化学方程式为____________,反应类型为____________。
(2)D的化学名称是____________,由D生成E的化学方程式为:____________。
(3)G的结构简式为____________。
(4)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
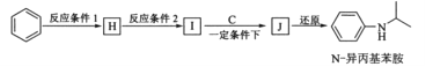
反应条件1所选择的试剂为____________;反应条件2所选择的试剂为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)所测土壤的酸碱性如何?
(2)所用氨水的pH和c(OH﹣)分别为多少?
(3)为使该滤液呈中性,所加入氨水的恰当体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为_____kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a____________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
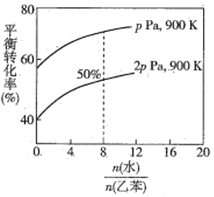
①加入水蒸气稀释剂能提高乙苯转化率的原因是________________________________。
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为________ (答两点)。
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=_______。
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是________ (填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛: ![]() (g) + 2O2→
(g) + 2O2→![]() + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年四川九寨沟“8.8”地震导致多人脑损伤,L为治疗脑损伤的药物,合成L的线路如下:
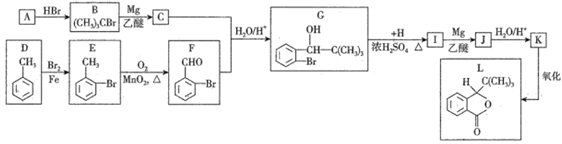
已知:①F能发生银镜反应;
②R-Br+Mg![]() RMgBr(格氏试剂),格氏试剂能与羰基发生反应,如:R'-CHO+RMgBr→
RMgBr(格氏试剂),格氏试剂能与羰基发生反应,如:R'-CHO+RMgBr→![]() +Mg(OH)Br。
+Mg(OH)Br。
请回答下列问题:
(1)烃A的化学名称为________________。
(2)C+F→G发生反应的类型依次为_________、_________。
(3)H的结构简式是_____________,L的分子式为______________。
(4)D→E的化学反应方程式为_________________________________。
(5)1molI(酯类有机物)与足量NaOH反应,消耗NaOH的物质的量为_________ mol。
(6)X为G的同分异构体,满足下列条件:
①遇FeCl3溶液显紫色②有两个甲基直接连在苯环上③苯环上的一氯代物只有1种其中核磁共振氢谱为4组峰的X的结构简式为_________、_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com