
【题目】2017年四川九寨沟“8.8”地震导致多人脑损伤,L为治疗脑损伤的药物,合成L的线路如下:
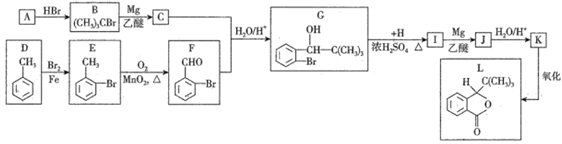
已知:①F能发生银镜反应;
②R-Br+Mg![]() RMgBr(格氏试剂),格氏试剂能与羰基发生反应,如:R'-CHO+RMgBr→
RMgBr(格氏试剂),格氏试剂能与羰基发生反应,如:R'-CHO+RMgBr→![]() +Mg(OH)Br。
+Mg(OH)Br。
请回答下列问题:
(1)烃A的化学名称为________________。
(2)C+F→G发生反应的类型依次为_________、_________。
(3)H的结构简式是_____________,L的分子式为______________。
(4)D→E的化学反应方程式为_________________________________。
(5)1molI(酯类有机物)与足量NaOH反应,消耗NaOH的物质的量为_________ mol。
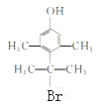
(6)X为G的同分异构体,满足下列条件:
①遇FeCl3溶液显紫色②有两个甲基直接连在苯环上③苯环上的一氯代物只有1种其中核磁共振氢谱为4组峰的X的结构简式为_________、_________。
【答案】 2-甲基-1-丙烯 加成反应 取代反应 HCOOH C12H14O2 ![]() +Br2
+Br2![]() +HBr 3
+HBr 3 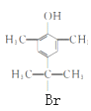
【解析】根据流程图,各物质的结构简式如下:A、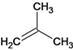 、B、
、B、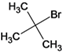 、C、
、C、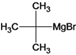 、D、
、D、![]() 、E、
、E、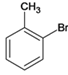 、F、
、F、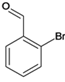 、G、
、G、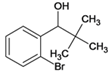 、I、
、I、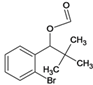 、J、
、J、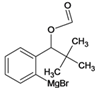 、K、
、K、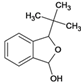 、L、
、L、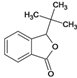
(1)烃A 的化学名称为 2-甲基-1-丙烯。(2)C+F→G:
的化学名称为 2-甲基-1-丙烯。(2)C+F→G:![]() 与
与 生成
生成![]() 发生反应的类型依次为加成反应、取代反应。(3)H的结构简式是HCOOH,L
发生反应的类型依次为加成反应、取代反应。(3)H的结构简式是HCOOH,L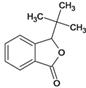 的分子式为C12H14O2 。(4)D、
的分子式为C12H14O2 。(4)D、![]() 、E、
、E、 ,D→E发生取代反应,化学反应方程式为
,D→E发生取代反应,化学反应方程式为 ![]() +Br2
+Br2![]() +HBr 。
+HBr 。
(5)1molI(酯类有机物)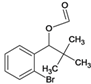 与足量NaOH反应,酯基消耗1molNaOH,苯环上的Br消耗2molNaOH,消耗NaOH的物质的量为3 mol。(6)X为G
与足量NaOH反应,酯基消耗1molNaOH,苯环上的Br消耗2molNaOH,消耗NaOH的物质的量为3 mol。(6)X为G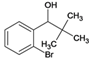 的同分异构体,满足下列条件:①遇FeCl3溶液显紫色,有酚羟基;②有两个甲基直接连在苯环上,处于对称的位置;③苯环上的一氯代物只有1种其中核磁共振氢谱为4组峰,余下的3个碳和下个Br原子,只能在对称轴上,X的结构简式为
的同分异构体,满足下列条件:①遇FeCl3溶液显紫色,有酚羟基;②有两个甲基直接连在苯环上,处于对称的位置;③苯环上的一氯代物只有1种其中核磁共振氢谱为4组峰,余下的3个碳和下个Br原子,只能在对称轴上,X的结构简式为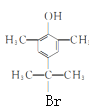 、
、 。
。


科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极,e、f是小试管。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。

请回答下列问题:
(1)直流电源中,M为_______极。
(2)Pt电极上生成的物质是_______,其质量为______g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:__________。
(4)AgNO3溶液的浓度________(填增大、减小或不变。下同),H2SO4溶液的pH_________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)主要用于棉纺、亚麻、腈纶、涤纶等纤维漂白(不适于羊毛、绢丝、粘胶丝、尼龙等),也可用于食品、饮用水消毒、纸张漂白和鱼药制造。工业上常用电解法生产亚氯酸钠(NaClO2),请根据下面的工艺流程图回答下列问题:

已知:纯的ClO2易分解爆炸。一般用稀有气体或空气稀释到10%以下安全。
(1)电解饱和NaCl溶液之前须除去其中的Ca2+、Mg2+、SO42-等杂质,依次加入BaCl2溶液、Na2CO3溶液、NaOH溶液,充分反应后将沉淀一并滤去,若经检测发现滤液中SO42-的浓度仍大于10-5mol·L -1,其可能的原因为____________________,滤液中c(CO32-)∶c(SO42-)为____________。[已知:Ksp(BaSO4 )= 1.0×10 -10,Ksp(BaCO3 )= 5.0×10-9 ]
(2)无隔膜电解槽内发生的反应中氧化产物、还原产物的物质的量之比为____________。
(3)将制得的ClO2 通入电解槽的阴极室,饱和NaCl溶液通入电解槽的阳极室,通电一段时间后可得到产品,电解时阴极的电极反应式为_____________________________。
(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,反应的离子方程式为______________。
(5)ClO2溶液的浓度含量可用碘量法测定,其原理为在盐酸介质中ClO2与I-发生反应:2ClO2+8H++10I-=2Cl-+5I2+4H2O,再用Na2S2O3标准液滴定生成的I2,通过计算即可确定ClO2溶液浓度含量。已知:I2+2Na2S2O3=2NaI+Na2S4O6。
①滴定过程中需要滴加的指示剂为____________。
②取V1 mL的ClO2溶液加入到适量的盐酸和KI溶液中,反应完毕后再用0.lmol·L-1 的Na2S2O3溶液滴定反应后的溶液,若消耗了V2mL的Na2S2O3溶液,则ClO2 的浓度为____________ g·L-1。(杂质不参与反应,ClO2 的还原产物为Cl- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用如图所示装置制备、干燥、收集气体的是( )
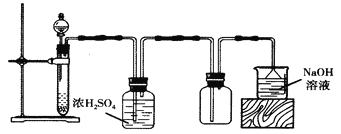
A. 以MnO2、浓盐酸为原料,制备Cl2
B. 以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C. 以浓氨水、生石灰为原料,制备NH3
D. 以Cu、稀硝酸为原料,制备NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能( ) 
组别 | c(HCl)(molL﹣1) | 温度(℃) | 状态 |
A | 2.0 | 25 | 块状 |
B | 2.5 | 30 | 块状 |
C | 2.5 | 50 | 粉末状 |
D | 2.5 | 50 | 块状 |
A.D﹣C﹣A﹣B
B.C﹣D﹣B﹣A
C.A﹣B﹣C﹣D
D.A﹣B﹣D﹣C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油分馏可获得乙烯、丙烯和丁二烯
B.将重油经过裂化可以得到汽油
C.将石油裂解制得乙烯等化工原料
D.石油裂化的目的是提高汽油等轻质燃料的产量和质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为消除氮氧化物(NOx)的污染,可采用甲烷催化还原法:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867kJ/mol
则△H2=_________。
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。
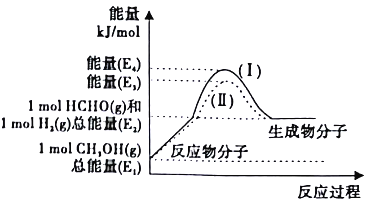
①写出上述反应的热化学方程式______________。
②反应热大小比较:过程I______过程II(填“大于”、“小于”或“等于”)。
③上述反应过程中,需向体系中通入适量空气,控制条件消耗体系中的H2,既提高甲醛产率,同时使反应温度保持不变,则理论上n(CH3OH):n(空气)=________。(已知:H2(g)+![]() O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
O2(g)==H2O(g) △H=-akJ/mol,空气中O2的体积分数为0.2)
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
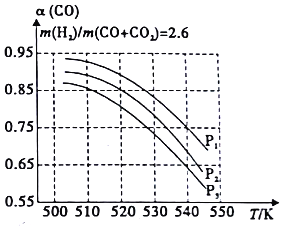
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。图中的压强由大到小顺序为_____,判断理由是_____________;试解释CO平衡转化率随温度升高面减小的原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com