
【题目】铜及其化合物在科研和生产中具有广泛用途。回答下列问题:
(l)基态Cu原子的价电子排布图是____。
(2)从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因是____。
(3)铜晶体中Cu原子的堆积方式如图所示,其堆积方式为____,配位数为____.

(4)NH3中N原子的杂化方式是____;C、N、O元素的第一电离能由大到小的顺序是____(用元素符号表示);SO42-的空间构型是____,与该阴离子互为等电子体的五核微粒有____ (任写1种)。
(5)由铜、钡、钙及铊的氧化物可以制得高温超导体,CaO的熔点比BaO的熔点高,其原因是____。

(6)金铜合金的晶胞如图所示。金铜合金具有储氢功能,储氢后Au原子位于顶点,Cu原子位于面心,H原子填充在由1个Au原子和距Au原子最近的3个Cu原子构成的四面体空隙中,若Cu原子与Au原子的最短距离为a nm,阿伏加德罗常数的值为NA,则该晶体储氢后密度为___________g.cm-3(列出计算式)。
【答案】![]() 亚铜离子核外电子处于稳定的全充满状态 面心立方最紧密堆积 12 sp3 N>O>C 正四面体 PO43-、ClO4- CaO的晶格能大于BaO的晶格能
亚铜离子核外电子处于稳定的全充满状态 面心立方最紧密堆积 12 sp3 N>O>C 正四面体 PO43-、ClO4- CaO的晶格能大于BaO的晶格能 ![]()
【解析】
(1)根据基态Cu原子的外围电子排布为写出价电子排布图;
(2)亚铜离子核外电子处于稳定的全充满状态;
(3)根据Cu原子的堆积方式图分析解答;
(4)NH3中N原子价电子对数为4,以此分析杂化方式;同周期元素的第一电离能随核电荷数的增加而增大,但N原子的2p轨道是半充满的稳定状态,所以N元素的第一电离能大于O;SO42-的中心原子硫原子的价层电子对数为![]() =4,没有孤电子对,以此分析空间构型;SO42-的价电子数为32,等电子体具有相同的价电子总数。
=4,没有孤电子对,以此分析空间构型;SO42-的价电子数为32,等电子体具有相同的价电子总数。
(5)CaO和BaO都是离子晶体,Ca2+离子半径小于Ba2+,CaO的晶格能大于BaO的晶格能;
(6)根据均摊法求出一个晶胞的质量和体积,再根据![]() =
=![]() 计算晶体密度。
计算晶体密度。
(1)基态Cu原子的外围电子排布为:3d104s1,则基态Cu原子的价电子排布图为:![]() ;
;
故答案为:![]() ;
;
(2)失去一个电子后,亚铜离子核外电子处于稳定的全充满状态,所以导致高温下Cu2O比CuO稳定;
故答案为:亚铜离子核外电子处于稳定的全充满状态;
(3)晶胞中Cu原子位于面心、顶点上,属于面心立方最密堆积;
以顶点Cu原子研究,与之相邻的原子处于面心,每个顶点为8故晶胞共用,每个面心为2个晶胞共有,故Cu原子配位数为3![]() =12;
=12;
故答案为:面心立方最紧密堆积;12;
(4)NH3中N原子价电子对数为4,则杂化方式是sp3;
同周期元素的第一电离能随核电荷数的增加而增大,但N原子的2p轨道是半充满的稳定状态,所以N元素的第一电离能大于O,则C、N、O三元素的第一电离能由大到小的顺序是N>O>C;
SO42-的中心原子硫原子的价层电子对数为![]() =4,没有孤电子对,所以SO42-的空间构型为正四面体;
=4,没有孤电子对,所以SO42-的空间构型为正四面体;
SO42-的价电子数为32,与SO42-互为等电子体的五核微粒有PO43-、ClO4-等。
故答案为:sp3 ;N>O>C;正四面体;PO43-、ClO4-等;
(5)CaO和BaO都是离子晶体,因为Ca2+离子半径小于Ba2+,CaO的晶格能大于BaO的晶格能,所以CaO的熔点比BaO的熔点高;
故答案为:CaO的晶格能大于BaO的晶格能;
(6)Au原子在晶胞占有的位置为8个顶点,Au原子的个数8![]() =1,Cu原子在晶胞的位置在面心,Cu原子的个数是6
=1,Cu原子在晶胞的位置在面心,Cu原子的个数是6![]() =3,H原子在晶胞内部,共有8个,则该晶体一个晶胞的质量为
=3,H原子在晶胞内部,共有8个,则该晶体一个晶胞的质量为![]() g;
g;
若Cu原子与Au原子的最短距离为a nm,则晶胞立方体的棱长为/span>![]() a nm,一个晶胞的体积为(
a nm,一个晶胞的体积为(![]() a
a![]() 10-7cm)3=2
10-7cm)3=2![]() a3
a3![]() 10-21cm3,则该晶体储氢后密度为
10-21cm3,则该晶体储氢后密度为![]() g.cm-3,
g.cm-3,
故答案为:![]() 。
。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】分析下图的能量变化示意图,下列选项正确的是( )

A. C(g)=A(g)+1/2B(g) △H>0 B. 2C=2A+B △H>0
C. 2A(g)+B(g)=2C(g) △H>O D. A(g)+1/2B(g)=C(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)49 g H2SO4的物质的量是________;1.5 mol H2SO4的质量是________,其中含有_______mol SO42-,______mol H,含有______g O。
(2)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为________mol/L。
(3)若从中取出50 mL,其物质的量浓度为_______ mol/L;溶质的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应的是
A. HCl+NaOH=NaCl+H2O B. Fe+CuSO4=Cu+FeSO4
C. CO2+2NaOH=Na2CO3+H2O D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液存在H2CO3/HCO3—、HPO42-/H2PO4—等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值lg x[x表示![]() 或
或![]() ]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是
]与pH的关系如图所示。已知碳酸pKal═6.4、磷酸pKa2═7.2 (pKa═ -lgKa)。则下列说法不正确的是

A. 曲线Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. a~b的过程中,水的电离程度逐渐增大
C. 当c(H2CO3) ═c (HCO3—)时,c(HPO42—)=c(H2PO4—)
D. 当pH增大时,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.向等质量的Na2CO3和NaHCO3 固体中分别加入足量盐酸,后者产生的CO2多
C.可用相同的离子方程式表示Na2CO3和NaHCO3分别与硝酸的反应
D.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中所示的装置图能够达到实验目的是( )
A. 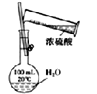 配制一定浓度的稀硫酸
配制一定浓度的稀硫酸
B. 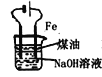 实验室制备Fe(OH)2
实验室制备Fe(OH)2
C. 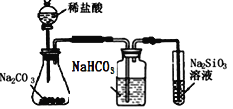 比较氯、碳、硅三种元素的非金属性强弱
比较氯、碳、硅三种元素的非金属性强弱
D.  加热熔融NaOH固体
加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示。下列说法正确的是

A. 电极b为电池负极
B. 电路中每流过4mol电子,正极消耗44.8LH2S
C. 电极b上的电极反应为:O2+4e-+4H+=2H2O
D. 电极a上的电极反应为:2H2S+2O2--4e-=S2+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com