
【题目】A~H等八种物质存在如下转化关系(反应条件、部分产物未标出)。已知:A为正盐,B是能使品红溶液褪色的气体,E是碱性气体,G是红棕色气体。按要求回答问题:
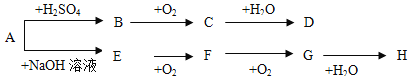
(1)写出下列物质的化学式:B ,D ,E ,F 。
(2)设计实验检验A溶液中的阳离子,写出实验操作、现象和结论 。
【答案】(1)SO2;H2SO4;NH3;NO
(2)取少量溶液于试管中,向其中加入加入浓NaOH溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+,否则没有。
【解析】B是能使品红溶液褪色的气体,B是SO2,E是碱性气体,E和氧气反应生成F,F和氧气反应生成G,G是红棕色气体,G是NO2,那么E是NH3, A为正盐与H2SO4反应生成SO2,那么A含有SO32-,与NaOH反应生成NH3,A是(NH4)2SO3,(1)B是SO2,C是SO3,D是H2SO4,E是NH3,F是NO,答案为:SO2;H2SO4;NH3;NO;(2)铵根离子的检验,主要是用铵盐和碱反应生成氨气,氨气呈碱性,能使石蕊的红色石蕊试纸变红,答案为:取少量溶液于试管中,向其中加入加入浓NaOH溶液并加热,若产生能使湿润的红色石蕊试纸变蓝的气体,则证明有NH4+,否则没有。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
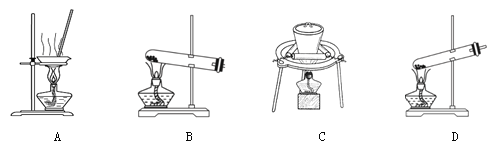
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类健康或生活实际的角度考虑,下列叙述正确的是
A.用铝锅可长时间盛放酸性食物
B.氯气泄漏后应顺风向低处跑
C.食用“加碘”食盐不利于健康
D.用食醋可除去水壶中的水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
C.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
D.饱和溶液一定比不饱和溶液的浓度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、
CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2 溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,
沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- (是或否)
(2)由第二份进行的实验可知混合物中应含 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是( )
A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol
B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl-
C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl-
D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A | B | C | D | |
甲 | 物质中的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
乙 | 阿伏加德罗常数 | 标准状况下的气体的体积 | 固体的密度 | 溶液体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
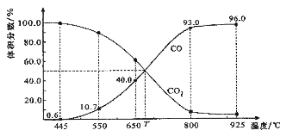
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M为原子序数依次增大的短周期元素。X原子半径最小、Y元素形成化合物种类最多、Z元素的氢化物水溶液呈碱性、常温下L可以形成两种液态氢化物,M的最高价氧化物对应的水化物呈两性。回答下列问题:
(1)L元素形成单质的名称为____________;M在元素周期表中的位置为_________;五种元素的原子半径从大到小的顺序是______________(用元素符号表示)。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为_________,B的结构式为__________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______________。
(4)写出由X、Z、L三种元素组成的离子化合物与NaOH溶液加热反应的离子方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com