
����Ŀ������������������ʳ�ν϶��ʹ���˵����(KIO3)��������ڹ�ҵ�Ͽ��õ�ⷨ��ȡ����ʯī�Ͳ����Ϊ�缫����KI��ҺΪ���Һ����һ�������µ�⣬��Ӧ����ʽΪ��KI+3H2O![]() KIO3+3H2���������й�˵����ȷ����( )
KIO3+3H2���������й�˵����ȷ����( )
A. ���ʱ��ʯī������������������� B. ���ʱ������Ӧ�ǣ�I����6e��+3H2O=IO3��+6H+
C. ��Һ������ǿ���ԣ����������� D. ������Һ��pH����
���𰸡�B
��������
����A.�ɵ�ⷽ��ʽ��֪���ڷ�Ӧ��I-ʧȥ���ӱ�ΪIO3-����˵��ʱ��ʯī���������������������A����;B�����ܷ�Ӧ����ʽ��֪�����ʱ��������Ӧ�ǣ�I��-6e �C+ 3H2O = IO3��+ 6H+,B��ȷ;C����Һ������ǿ���ԣ����벻��ֵ缫��Ӧ��������������C����D.��ⷴӦ����ʽΪ��KI + 3H2O![]() KIO3 + 3H2������Ӧ��������ˮ����KI��ǿ��ǿ���Σ���Һʼ�ճ����ԣ�PH=7��D����ѡB��
KIO3 + 3H2������Ӧ��������ˮ����KI��ǿ��ǿ���Σ���Һʼ�ճ����ԣ�PH=7��D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������˳-��ϩ��������![]() ��һ����Ҫ�Ļ���ԭ�ϣ������ںϳɿɽ���ĸ߾���PES��֬�Լ����п��������ԵĻ�����K��
��һ����Ҫ�Ļ���ԭ�ϣ������ںϳɿɽ���ĸ߾���PES��֬�Լ����п��������ԵĻ�����K��

��֪����![]()
��
��![]() (R1��R2��R3��������)
(R1��R2��R3��������)
�ش��������⣺
��1��C��������________����Ӧ�ڵķ�Ӧ������___________��
��2��B��˳ʽ�ṹ��ʽΪ_________��F�Ľṹ��ʽΪ__________��
��3����Ӧ�ٵĻ�ѧ����ʽΪ_________��
��4��C�ж���ͬ���칹�壬������C������ȫ��ͬ�Ĺ����ţ��Һ˴Ź�������ֻ���������ͬ���칹��Ľṹ��ʽΪ______�������������칹����
��5����֪������(-NH2)���ǻ����ƣ�Ҳ�ܷ�����Ӧ�١�����F�Ʊ�K�Ĺ����У��������������L��L����ʽΪC16H13NO3����������Ԫ������L�Ľṹ��ʽΪ______��
��6����֪��������ˮ��Һ�м���ˮ�⡣д������������![]() �ϳɾ�ʯ��
�ϳɾ�ʯ��![]() �ĺϳ�·�ߣ�____________________��
�ĺϳ�·�ߣ�____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����
A. ú�к��б����ױ��ʹְ�ˮ����ͨ������õ�
B. C4H8Cl2��ͬ���칹����7��
C. �ױ����ұ������ڹ�ƽ���̼ԭ��������Ϊ7
D. ���Ҵ���������������֮������ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2.0mol PCl3��1.0mol Cl2�������������ܱ������У���һ�������·���������Ӧ��PCl3+Cl2![]() PCl5����ƽ��ʱ��PCl5Ϊ0.40mol�������ʱ����1.0mol PCl3��0.50mol Cl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ����ǣ� ��
PCl5����ƽ��ʱ��PCl5Ϊ0.40mol�������ʱ����1.0mol PCl3��0.50mol Cl2������ͬ�¶����ٴ�ƽ��ʱPCl5�����ʵ����ǣ� ��
A. 0.40mol B. 0.20mol
C. ��0.20mol D. ����0.20mol����0.40mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+ �����ø÷�Һ�Ʊ����������[( NH4) 2S2O8]��TiO2��һ�ֹ�����������:

��֪��i.TiOSO4����ˮ����ˮ������H2TiO3,��������γ��������������pH��Χ�� �±�:
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������pH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 ʱ,Fe2+�������� Fe( ��)������Fe(NH3)2]2+o
��ش���������:
(1)��������Fe��������________________ .
(2)����TiO(OH)2�Ļ�ѧ����ʽΪ_______________ ��
(3)����I������II�����е����ʵĻ�ѧʽΪ_____________ .
(4)����H2O2��Ŀ���dz���Fe( ��)��������[Fe(NH3)2]2+,�˹������������뻹ԭ�������ʵ���֮�������ϵ���________ (����ֵ)��
(5)�����£���������Ҫ������ʽ��pH�Ĺ�ϵ����ͼ��ʾ��

��Pt�缫��ⱥ��NH4HSO4��Һ�Ʊ����������ʱ��Ϊ�����������ŵ��������ҪΪ HSO4-��Ӧ������������Һ��pH��Χ��______֮��,��缫��ӦʽΪ____________ ��
(6)������Ա�����������[NH4Fe(SO4)2]�ζ����ⶨTiO2�Ĵ��ȣ��䲽��Ϊ�� ���������ܽ�wg ����������Ʒ������������ԭ�������ˡ�ϴ�ӣ�����Һ����Ϊ100 mL,ȡ 25.00 mL,��NH4SCN��ָʾ�����ñ����������Һ�ζ����յ㣬��Ӧԭ��Ϊ: Ti3++Fe3+=Ti4++Fe2+��
���жϵζ��յ�ķ�����________________________ ��
�ڵζ��յ�ʱ����c mol/L-1 NH4Fe(SO4)2��ҺVmL,��TiO2����Ϊ___________(д�������ĸ��ʾ�Ĵ���ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CH3OH(g)![]() CH3OCH3(g)��H2O(g)����H����25 kJ/mol��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£���1 L���ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�����£�
CH3OCH3(g)��H2O(g)����H����25 kJ/mol��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£���1 L���ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ����ʵ���Ũ�����£�
���� | CH3OH | CH3OCH3 | H2O |
c/(mol��L��1) | 0.8 | 1.24 | 1.24 |
����˵����ȷ����(����)
��ƽ��������¶ȣ�ƽ�ⳣ��>400
��ƽ��ʱ��c(CH3OCH3)��1.6 mol/L
��ƽ��ʱ����Ӧ��������������С20 kJ
��ƽ��ʱ���ټ�������ʼ������CH3OH������ƽ���CH3OHת��������
�ݴ�ʱ�̷�Ӧ�ﵽƽ��״̬
��ƽ��ʱCH3OH��Ũ��Ϊ0.08 mol��L��1
A. �٢ڢܢ� B. �ڢ� C. �ڢۢܢ� D. �ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PET��һ����������ƿ�����ϡ����л���A(����ʽΪC9H9O2Br)�ϳ�PET��F��ת ����ϵ����ͼ������DΪ���һ�������,������Һ��ԭ�ϼ��м��塣A��C��D��E����NaHCO3��Һ��Ӧ��

��֪��I.A���ӵĺ˴Ź����������������,�����֮��Ϊ1 �� 2 �� 2 �� 2 �� 2
II (R1��R2������������ԭ��)
(R1��R2������������ԭ��)
��ش�����������
(1) ������D�ķ���ʽΪ_______����Ӧ�ٵķ�Ӧ������__________��Ӧ��
(2)�߷��ӻ�����F�Ľṹ��ʽΪ_________.
(3) ��Ӧ�ݵĻ�ѧ����ʽΪ______________________��
(4)���÷�Ӧ�ٺ����Һ�����ʵ��֤��A�����к��е�±��ԭ��Ϊ��ԭ�ӵ�ʵ�鲽�������Ϊ________________________
(5)д��������������D��ͬ���칹��Ľṹ��ʽ_______________________.
a.�ܷ���������Ӧ b.����FeCl3.��Һ������ɫ��Ӧ c.�����ϵ�һ�ȴ���ֻ��һ��
(6)д������ϩΪ��ʼԭ���Ʊ���Ԫ����( )�ĺϳ�·��(�����Լ���ѡ)___________________
)�ĺϳ�·��(�����Լ���ѡ)___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
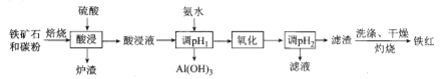
����Ŀ��������״������(��Ҫ����![]() ������
������![]() ��CaO��
��CaO��![]() ��)���ҹ�һ����Ҫ�ij�����������Դ���Ը�����״������Ϊԭ���Ʊ����Ƚϸߵ����죬��������ͼ��ʾ������˵���������
��)���ҹ�һ����Ҫ�ij�����������Դ���Ը�����״������Ϊԭ���Ʊ����Ƚϸߵ����죬��������ͼ��ʾ������˵���������
A. ������������ᡢ��ī����������ɫ��
B. ���Һ��![]() ��Һ������ɫ����
��Һ������ɫ����
C. ϴ������ʱҪ�ò��������Ͻ���
D. ����ʱѡ�õ��Լ�������![]() ��NaClO��Һ
��NaClO��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A. ��״���£�22.4L�����к��з�����ĿΪNA
B. 1mol/LNaOH��Һ�к���Na+��ĿΪNA
C. 7.8gNa2O2�к��еĹ��ۼ���ĿΪ0.1NA
D. ��0.5molN2O4�����ܱ������г�ַ�Ӧת����NO2����ĿΪNA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com