
����Ŀ��PET��һ����������ƿ�����ϡ����л���A(����ʽΪC9H9O2Br)�ϳ�PET��F��ת ����ϵ����ͼ������DΪ���һ�������,������Һ��ԭ�ϼ��м��塣A��C��D��E����NaHCO3��Һ��Ӧ��

��֪��I.A���ӵĺ˴Ź����������������,�����֮��Ϊ1 �� 2 �� 2 �� 2 �� 2
II (R1��R2������������ԭ��)
(R1��R2������������ԭ��)
��ش�����������
(1) ������D�ķ���ʽΪ_______����Ӧ�ٵķ�Ӧ������__________��Ӧ��
(2)�߷��ӻ�����F�Ľṹ��ʽΪ_________.
(3) ��Ӧ�ݵĻ�ѧ����ʽΪ______________________��
(4)���÷�Ӧ�ٺ����Һ�����ʵ��֤��A�����к��е�±��ԭ��Ϊ��ԭ�ӵ�ʵ�鲽�������Ϊ________________________
(5)д��������������D��ͬ���칹��Ľṹ��ʽ_______________________.
a.�ܷ���������Ӧ b.����FeCl3.��Һ������ɫ��Ӧ c.�����ϵ�һ�ȴ���ֻ��һ��
(6)д������ϩΪ��ʼԭ���Ʊ���Ԫ����( )�ĺϳ�·��(�����Լ���ѡ)___________________
)�ĺϳ�·��(�����Լ���ѡ)___________________
���𰸡�C9H10O2 ��ȥ 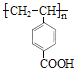
![]() ȡ��Ӧ�ٺ�Ļ��Һ�����������м���ϡHNO3�����ԣ��μ�AgNO3��Һ��������dz��ɫ��������A�к���ԭ��
ȡ��Ӧ�ٺ�Ļ��Һ�����������м���ϡHNO3�����ԣ��μ�AgNO3��Һ��������dz��ɫ��������A�к���ԭ�� 
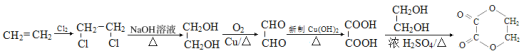
��������
A���������ƵĴ���Һ�·�����ȥ��Ӧ����B��B�ữ����C��C��Ni�Ĵ�����H2�����ӳɷ�Ӧ�� DΪ![]() ,����CΪ
,����CΪ![]() ��BΪ
��BΪ![]() ��A���ӵĺ˴Ź����������������,�����֮��Ϊ1 �� 2 �� 2 �� 2 �� 2����AΪ
��A���ӵĺ˴Ź����������������,�����֮��Ϊ1 �� 2 �� 2 �� 2 �� 2����AΪ![]() ��D�����Ը�����ط�Ӧ����E��
��D�����Ը�����ط�Ӧ����E��![]() ����E���Ҷ����������۷�Ӧ����
����E���Ҷ����������۷�Ӧ����![]() ��Cһ�����������Ӿ۷�Ӧ����F��FΪ
��Cһ�����������Ӿ۷�Ӧ����F��FΪ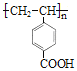 ��
��
��1��DΪ![]() ������ʽΪC9H10O2��A���������ƵĴ���Һ�·�������±��������ȥ��Ӧ���ɣ��𰸣�C9H10O2����ȥ��
������ʽΪC9H10O2��A���������ƵĴ���Һ�·�������±��������ȥ��Ӧ���ɣ��𰸣�C9H10O2����ȥ��
��2���߷��ӻ�����F����C�Ӿ۵õ����ṹ��ʽΪ ���𰸣�
���𰸣� ��
��
��3����Ӧ����![]() ���Ҷ����������۷�Ӧ����
���Ҷ����������۷�Ӧ����![]() �����Ի�ѧ����ʽΪ
�����Ի�ѧ����ʽΪ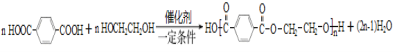 ���𰸣�
���𰸣�![]() ��
��
��4����Ӧ����![]() ����ȥ��Ӧ��������֤�����е�HBr�е�Br-�Ϳ�֤��A�����к��е�±��ԭ��Ϊ��ԭ�ӣ����Կ�ȡ��Ӧ�ٺ�Ļ��Һ�����������м���ϡHNO3�����ԣ��μ�AgNO3��Һ��������dz��ɫ��������A�к���ԭ�ӣ��𰸣���ȡ��Ӧ�ٺ�Ļ��Һ�����������м���ϡHNO3�����ԣ��μ�AgNO3��Һ��������dz��ɫ��������A�к���ԭ�ӣ�
����ȥ��Ӧ��������֤�����е�HBr�е�Br-�Ϳ�֤��A�����к��е�±��ԭ��Ϊ��ԭ�ӣ����Կ�ȡ��Ӧ�ٺ�Ļ��Һ�����������м���ϡHNO3�����ԣ��μ�AgNO3��Һ��������dz��ɫ��������A�к���ԭ�ӣ��𰸣���ȡ��Ӧ�ٺ�Ļ��Һ�����������м���ϡHNO3�����ԣ��μ�AgNO3��Һ��������dz��ɫ��������A�к���ԭ�ӣ�
��5��DΪ![]() ���ܷ���������Ӧ˵����Ҫ��ȩ��������FeCl3��Һ������ɫ��Ӧ˵����Ҫ�з��ǻ��������ϵ�һ�ȴ���ֻ��һ�֣���ͬ���칹����
���ܷ���������Ӧ˵����Ҫ��ȩ��������FeCl3��Һ������ɫ��Ӧ˵����Ҫ�з��ǻ��������ϵ�һ�ȴ���ֻ��һ�֣���ͬ���칹����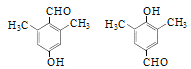 ���𰸣�
���𰸣� ��
��
��6����Ԫ����(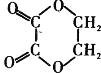 )����������������ͨ���Ҷ�����Ҷ�������������Ӧ���ɣ����Ժϳ���·Ϊ��
)����������������ͨ���Ҷ�����Ҷ�������������Ӧ���ɣ����Ժϳ���·Ϊ��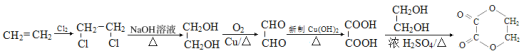 ����;
����;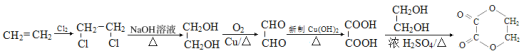 ��
��
��Ӧ���� | ���ܹ����� |
Ũ���� | �ٴ�����ȥ�����ǻ�����������Ӧ�������ǻ����Ȼ��� |
ϡ���� | ������ˮ�⣨���������� �ڶ��ǡ����ǵ�ˮ�� |
NaOHˮ��Һ | ��±������ˮ�� ������ˮ�� |
NaOH����Һ | ±������ȥ����X�� |
H2������ ��Ni�� | �ӳ�(̼̼˫����̼̼������ȩ�����ʻ�������)��һ���Ȼ�����������H2�ӳ� |
O2/Cu������ | ���ǻ� ����CH2OH����CHOH�� |
Cl2(Br2)/Fe | ��������ԭ�ӱ�ȡ�� |
Cl2(Br2)/���� | ��������������������ԭ�ӱ�ȡ�� |
��ʯ��/���� | R��COONa |


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�����е�Ca2+��Mg2+��SO42-����ɳ,�ɽ���������ˮ��Ȼ������������������������ȷ�IJ���˳����( )
�ٹ��ˢڼӹ�����NaOH��Һ �ۼ�����HCl�ܼӹ�����Na2CO3��Һ�ݼӹ�����![]() ��Һ
��Һ
A.�ڢۢܢݢ�B.�ܢ٢ڢݢ�C.�ڢݢܢ٢�D.�ݢڢܢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��Կ��淴ӦA(g)+2B(g)![]() 3C(g)�����������У���˵����Ӧ�Ѵﵽƽ����ǣ� ��
3C(g)�����������У���˵����Ӧ�Ѵﵽƽ����ǣ� ��
A. C���ɵ�������C�ֽ���������
B. ��λʱ��������amolA��ͬʱ����3amolC
C. �����ڵ�ѹǿ���ٱ仯
D. �����������ʵ������ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ʳ�ν϶��ʹ���˵����(KIO3)��������ڹ�ҵ�Ͽ��õ�ⷨ��ȡ����ʯī�Ͳ����Ϊ�缫����KI��ҺΪ���Һ����һ�������µ�⣬��Ӧ����ʽΪ��KI+3H2O![]() KIO3+3H2���������й�˵����ȷ����( )
KIO3+3H2���������й�˵����ȷ����( )
A. ���ʱ��ʯī������������������� B. ���ʱ������Ӧ�ǣ�I����6e��+3H2O=IO3��+6H+
C. ��Һ������ǿ���ԣ����������� D. ������Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���봿ˮ�ĵ������ƣ�Һ����Ҳ���������ĵ�����2NH3![]() NH4++NH2-�ݴ��ж����������������
NH4++NH2-�ݴ��ж����������������
A. Һ���к���NH3��NH4��NH2-������
B. һ���¶���Һ����c(NH4+)��c(NH2-)��һ������
C. Һ���ĵ���ﵽƽ��c(NH3)= c(NH4+)=c(NH2-)
D. ֻҪ�������������ʣ�Һ����c(NH4+)=c(NH2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֽ�CO2��H2Oת��Ϊȼ��H2��CO��CH4��װ����ͼ��ʾ(�������ҺΪϡH2SO4)�����й��ڸ�װ�õ������������

A. ��װ�ÿɽ�����ת��Ϊ��ѧ��
B. ����ʱ���缫a��Χ��Һ��pH����
C. �缫b������CH4�ĵ缫��ӦʽΪCO2+8H++8e��===CH4+2H2O
D. ���缫b��ֻ����1 mol CO����ͨ������Ĥ��H+��Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���鼰�仯�����ڰ뵼�塢ũҩ����ȷ�����;�dz��㷺���ش��������⣺
��1��AsH3�ĵ���ʽΪ___��
��2���ı�0.1mol��L-1��Ԫ����H3AsO4��Һ��pH����Һ�е�H3AsO4��H2AsO4-��HAsO42-��AsO43-�����ʵ����ֲ�������pH�ı仯��ͼ��ʾ��

��lgKa1(H3AsO4)=_____��
���ü�����ָʾ������NaOH��Һ�ζ�H3AsO4��������Ҫ��Ӧ�����ӷ���ʽΪ___��
��3����̿���ұ����ʱ�������������в����Ȼ�ѧ��Ӧ���£�
��Ӧ��As2O3(g)+3C(s)![]() 2As(g)+3CO(g) ��H1=akJ��mol-1
2As(g)+3CO(g) ��H1=akJ��mol-1
��Ӧ��As2O3(g)+3C(s)![]()
![]() As4(g)+3CO(g) ��H2=bkJ��mol-1
As4(g)+3CO(g) ��H2=bkJ��mol-1
��Ӧ��As4(g)![]() 4As(g) ��H
4As(g) ��H
����H=____kJ��mol-1���ú�a��b�Ĵ���ʽ��ʾ����
�ڷ�Ӧ�д����Ļ��Ի���Ϊ������Ӧ������As4�������ͣ�ͬʱ���ڵķ�Ӧ��ʹAs4�����١�����������±���
��Ӧ�� | ��Ӧ�� | ||
��ܣ�kJ��mol-1�� | ����X | 56 | 75 |
����Y | 37 | 97 | |
���ϱ��жϴ���X____������������������������Y��������_____��
��4����Ӧ2As2S3(s)![]() 4AsS(g)+S2(g)��ƽ��ʱ������ѹ�Ķ���ֵlg��p/kPa�����¶ȵĹ�ϵ��ͼ��ʾ��
4AsS(g)+S2(g)��ƽ��ʱ������ѹ�Ķ���ֵlg��p/kPa�����¶ȵĹ�ϵ��ͼ��ʾ��

�ٶ�Ӧ�¶��£�B��ķ�Ӧ����v������_____v���棩������>����<������=������
��A�㴦��AsS(g)�ķ�ѹΪ____kPa���÷�Ӧ��Kp=_____kPa5��KpΪ�Է�ѹ��ʾ��ƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȤС���ͬѧΪ�ⶨijNa2CO3��NaCl�Ĺ���������Ʒ��Na2CO3��������������������ʵ�顣������벢��ɶ��й�����Ľ��

��1����ͬѧ��ͼ1��ʾװ�òⶨCO2��������ʵ��ʱϡ����������Ʒ�е�__________(����Na2CO3������NaCl��)������Ӧ������b��������__________��ϴ��ƿc��ʢװ����Ũ���ᣬ��Ũ�����������____________________��
��2����ͬѧ��ͼ2��ʾװ�ã�ȡһ����������Ʒm g������ϡ���ᷴӦ����ʵ�飬�����Ʒ��Na2CO3���������IJⶨ��
��ʵ��ǰ������װ�������Եķ������ȴ���a����bע��ˮ�����¶˲��������γ�һ��ˮ�����ٽ���Ͳ����������ѹ����b�¶˲������е�___________________����װ�����������á�
����ʵ�����ʱ����ֱ�Ӳ�õ�������CO2��______(�������������������)��
��3����ͬѧ����ͼ��ʾ�����Ͳ������ʵ�飺

�ٲ������漰��ʵ�������У�__________��ϴ�ӣ��������漰��ʵ�������и��__________��
�ڱ�ͬѧ�����Ʒ��Na2CO3����������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������������ڿ����м��ȣ����Թ۲쵽�е���ɫ�������ɣ���д���÷�Ӧ�ķ���ʽ��__________________________________��
��2����ʵ����ģ������Ƽ�Ʊ�̼���ƣ�һ���¶��£���һ��������NaCl��Һ��ͨ�백����NH3���ﵽ���ͺ��ٲ���ͨ��CO2��һ��ʱ����ֳ��������˵õ�NaHCO3������Ȼ����Һ���ù��̵��ܵĻ�ѧ����ʽΪ��____________________________________________��
��3������NaHCO3�õ�������Ʒ��ʵ���ҽ��д˲�����װ�ÿ�����_____________����ѡ���

��4��ijʵ��С��ͨ������ʵ��̽������������ˮ�ķ�Ӧ��

����MnO2��Ӧ�Ļ�ѧ����ʽΪ____________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com