
【题目】关于从碘水中萃取碘的实验,下列说法错误的是( )
A.分液漏斗使用前要检验其是否漏液
B.萃取剂要求不溶于水,且碘在其中的溶解度比在水中的大
C.注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液
D.该实验需要选用的仪器是烧杯、分液漏斗、铁架台(带铁圈)
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后强热可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体。
请回答下列问题:
(1)请写出步骤一的化学方程式____________________________,此反应不能用瓷坩埚,原因是(用化学方程式表示)_________________________________;
(2)否用浓盐酸代替步骤二中的CO2 ,请简要分析原因__________________________;
(3)部分化合物的溶解度随温度的变化如下表所示,从步骤二反应后的混合溶液中分离得到高锰酸钾晶体的方法是蒸发浓缩、_____________,过滤、洗涤、烘干。为进一步增加得到的产品(高锰酸钾晶体)的纯度,常采用的实验方法是____________;
一些化合物的溶解度S/g(100g H2O)-1
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 |
K2CO3 | 51.3 | 52.0 | 52.5 | 53.2 | 53.9 | 54.8 |
KMnO4 | 2.83 | 4.4 | 9.0 | 12.7 | 16.9 | 22.2 |
(4)按以上方法制备高锰酸钾,每3 mol K2MnO4彻底反应理论上生成_________mol KMnO4;为增大锰酸钾的原子利用率,更好的制备方法是电解法。以K2MnO4溶液为电解液,采用惰性电极电解,当阴极在标准状况下产生5.6 L H2时,产生KMnO4的物质的量是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL HCl和H2SO4的混合溶液中逐滴加入0.1 mol·L-1的Ba(OH)2溶液,生成沉淀的质量和溶液的pH与加入的Ba(OH)2溶液体积的关系如图5所示。试完成下列问题:
 图5
图5
(1)起始时,混合酸中硫酸的物质的量浓度为______________ mol·L-1。
(2)起始时,混合酸中盐酸的物质的量浓度为______________ mol·L-1。
(3)B点表示的沉淀的质量为______________g。
(4)A点表示溶液中的c(H+)为______________ mol·L-1,pH为______________。
(5)C点的pH为______________(pH可直接用对数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
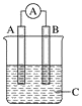
A. A是Zn,B是Cu,C为稀硫酸
B. A是Cu,B是Zn,C为稀硫酸
C. A是Fe,B是Ag,C为稀AgNO3溶液
D. A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为10 L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),最初加入1.0 mol A和2.2 mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
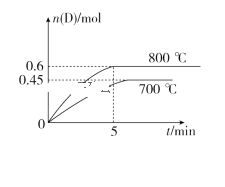
(1)800 ℃时,0~5 min内,以B表示的平均反应速率为________。
(2)能判断该反应达到化学平衡状态的依据是________(填字母)。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)利用图中数据计算800 ℃时的平衡常数K=________,该反应为________反应(填“吸热”或“放热”)。
(4)700 ℃时,某时刻测得另一同体积密闭容器中各物质的量如下:n(A)=1.1 mol,n(B)=2.6 mol,n(C)=0.9 mol,n(D)=0.9 mol,则此时该反应________(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com