
| A. | 只有② | B. | 只有②③ | C. | 只有①② | D. | 全部 |
分析 ①依据氯气是强氧化剂把铁氧化为三价分析;
②硝酸亚铁加入稀盐酸在溶液中形成强氧化剂稀硝酸分析;
③从铁和三价铁能反应,铁过量时无三价铁分析.
解答 解:①过量的Fe在Cl2中燃烧生成产物为氯化铁,由于是固体反应,过量的铁不会和三氯化铁反应,所以一定得到三价铁,故①符合;
②Fe与过量稀H2SO4反应生成硫酸亚铁和氢气,再向其中加KNO3,过量的氢离子和加入的硝酸根离子在溶液中形成稀硝酸强氧化剂,能把二价铁氧化为三价铁,故②符合;
③Fe和Fe2O3的混合物溶于稀盐酸,生成氯化亚铁和氯化铁,若铁足够量会和氯化铁反应生成氯化亚铁,故③不符合;
综上所述①②符合;
故选C.
点评 本题考查了铁及其化合物的化学性质的应用,过量反应的产物判断,注意溶液中隐含离子硝酸根在酸溶液中的强氧化性.


科目:高中化学 来源: 题型:解答题
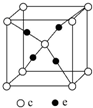 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A2(g)+B2(g)=2AB(g)△H<0 | |
| B. | 每生成2分子AB放出bkJ热量 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1molA-A键吸收akJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 17 | C. | 18 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铁跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 钠和冷水反应:2Na+2H2O=═2Na++2OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
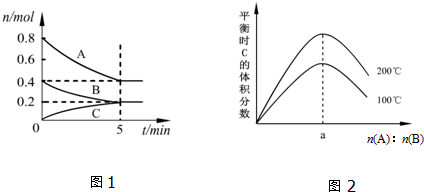
| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=2 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入1.6molA和0.8molB,达到平衡时,A的转化率大于50% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com