
分析 热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,根据热化学方程式的书写方法来回答.
解答 解:(1)1mol C2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量,即C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1411 kJ•mol-1,
故答案为:C2H4(g)+3O2(g)═2CO2 (g)+2H2O(l)△H=-1411 kJ•mol-1;
(2)1mol C2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8kJ热量,即C2H5OH(l)+3O2(g)═2CO2 (g)+3H2O(l)△H=-1366.8 kJ•mol-1,故答案为:C2H5OH(l)+3O2(g)═2CO2 (g)+3H2O(l)△H=-1366.8 kJ•mol-1;
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:解答题
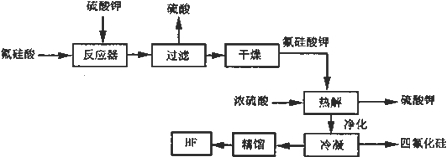
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有②③ | C. | 只有①② | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
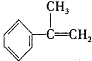 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式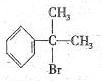 .
.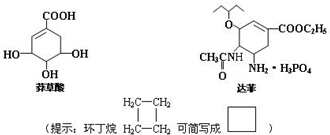
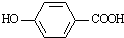 ),其反应类型为:消去反应;
),其反应类型为:消去反应;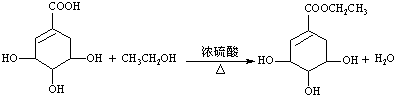 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 在标准状况下,22.4 LCH4与18 g H2O所含有的电子数均为10NA | |
| C. | 22.4 L CO气体与l molN2所含的电子数相等 | |
| D. | 1 mol HCl气体中的分子数与2L0.5 mo1/L盐酸中溶质分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
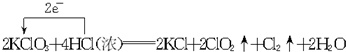 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -定量的Fe与含1molHNO3,的稀硝酸恰好反应,被还原的氮原子数小于NA | |
| B. | 1mol A1Cl3在熔融时离子总数为0.4NA | |
| C. | 常温常压下,等质量的S02、S2含有相同的分子数 | |
| D. | 125g CuS04•5H20 品体中含有0.5NA个Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的薄层水垢 | B. | 石油的分馏和煤的干馏 | ||
| C. | 用二氧化氯(ClO2)为自来水消毒 | D. | 液氨作制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com