
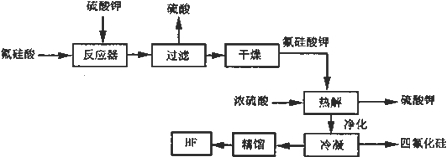
分析 氟硅酸加入硫酸钾发生反应生成氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,过滤得到硫酸和氟硅酸钾,干燥后在热水中水解成氟化钾、氟化氢及硅酸,加入浓硫酸反应得到硫酸钾、氟化氢、和四氯化硅等,净化冷凝,通过精馏得到纯净的氟化氢;
(1)氟硅酸加入硫酸钾发生反应生成氟硅酸钾和硫酸;
(2)氟硅酸钾微溶于水,不溶于醇,为减少损失可以用乙醇洗涤;
(3)反应过程中参与反应,在反应过程中又重新生成的物质可以循环使用,分析流程判断;
(4)标况下测得2.24L产物质量为3.1g,气体的质量远远大于2.0g的原因是氟化氢分子间可以形成氢键,部分结合形成双聚物
解答 解:氟硅酸加入硫酸钾发生反应生成氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,过滤得到硫酸和氟硅酸钾,干燥后在热水中水解成氟化钾、氟化氢及硅酸,加入浓硫酸反应得到硫酸钾、氟化氢、和四氯化硅等,净化冷凝,通过精馏得到纯净的氟化氢;
(1)氟硅酸加入硫酸钾发生反应生成氟硅酸钾和硫酸,反应器中的化学方程式为:H2SiF6+K2SO4=H2SO4+K2SiF6↓,
故答案为:H2SiF6+K2SO4=H2SO4+K2SiF6↓;
(2)在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤而不是用水,其目的是氟硅酸钾微溶于水,不溶于醇,为减少损失用乙醇洗涤,
故答案为:氟硅酸钾不溶于酒精,减少用水洗涤溶解氟硅酸钾损失;
(3)反应过程中参与反应,在反应过程中又重新生成的物质可以循环使用,分析流程判断流程中硫酸和硫酸钾在苯环过程中先参加反应,随后又生成,可以循环使用,
故答案为:H2SO4、K2SO4;
(4)标况下测得2.24L产物质量为3.1g,气体的质量远远大于2.0g的原因是氟化氢分子间可以形成氢键,部分结合形成双聚物,
故答案为:HF分子间形成氢键,部分缔合成双聚体.
点评 本题利用湿法制磷酸的副产品氟硅酸可以生产氟化氢的工艺为背景,通过流程分析,实验操作,生产条件的选择,流程中物质的循环使用等,考查分析应用的能力,掌握题干信息和物质性质是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 中和同体积同浓度的HAc和HCl,所需碱的物质的量是相同的 | |
| B. | 由H2CO3的解离平衡,可知溶液中[H+]和[CO32-]的比值=2:1 | |
| C. | 某弱酸溶液越稀,其电离度越大 | |
| D. | 强电解质溶液无离解常数,但可以有溶度积常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA | |
| C. | 常温常压下,32g O2和32g O3所含氧原子数都是2NA | |
| D. | 1 mol/L的盐酸溶液中含的离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
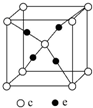 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
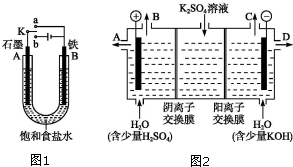 某课外活动小组用如图装置进行实验,试回答下列问题:
某课外活动小组用如图装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热该酸至沸腾也不分解 | |
| B. | 该酸浓度为0.01 mol•L-1时的pH为2 | |
| C. | 该酸可以把Al(OH)3沉淀溶解 | |
| D. | 该酸可以与石灰石反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | B. | 一定有CO32- | ||
| C. | 一定有Ag+ | D. | 可能有SO42-,也可能有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A2(g)+B2(g)=2AB(g)△H<0 | |
| B. | 每生成2分子AB放出bkJ热量 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1molA-A键吸收akJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com