
| A、基态锂原子的电子排布式是1s22p1 |
| B、离子晶体中可能含共价键 |
| C、熔点:Na2O>I2>SiO2 |
D、H2O2的电子式: |
 ,故D错误;
,故D错误;

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、m=4 R2+是氧化产物 |
| B、m=y R3+是氧化产物 |
| C、m=2 R3+是还原产物 |
| D、m=y R3+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL溶液中Ba2+离子浓度为0.4mol?L-1 |
| B、500mL溶液中Cl-离子浓度为0.4mol?L-1 |
| C、500mL溶液中Cl-离子总数为0.4NA |
| D、500mL溶液中Ba2+和Cl-离子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W和X位于第二周期 |
| B、Y和Z分别是Al和Si |
| C、W和X分别是O和F |
| D、Z的金属性可能比X的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH、Ca (OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 |
| B、Na、Mg、Al、Si的金属性逐渐增强 |
| C、HF、HCl、H2S、PH3的稳定性依次增强 |
| D、O、S、Na、K的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(2)(5) |
| B、(1)(4)(6) |
| C、(2)(4) |
| D、(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
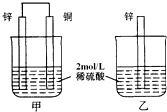 如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )
如图,甲中产生的H2的速率比乙中快,原因是乙中,H+要在锌片表面被还原,同时锌被氧化成Zn2+从锌片上脱落,H+和Zn2+都带正电,相排斥,所以H+不易直接从锌片上得电子;而甲中,H+在铜片上被还原,产生H2的速率比较快.下列有关表述错误的是( )| A、甲和乙中的反应不同 |
| B、甲为原电池,H+向正极移动 |
| C、甲中铜片表面的c(H+)比乙中锌片表面的c(H+)高 |
| D、若将2mol/L稀硫酸改为2mol/LCuSO4溶液,则乙中溶液更快褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com