
【题目】为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,商品供应商在包装袋中应放入的化学物质是( )
A.生石灰、蔗糖
B.硅胶(具有吸湿性)、硫酸亚铁
C.食盐、硫酸亚铁
D.生石灰、食盐
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
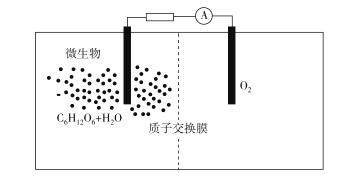
A. 负极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 正极反应式为O2+4e-+2H2O=4OH-
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是:( )
A.加入硫酸铜溶液加快实验室制氢气的速率
B.硫酸铝溶液不能放在铁质容器中
C.用热的纯碱溶液去除油污
D.浓硫化钠溶液有硫化氢的气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理使用食品添加剂既不会影响人体健康,又能有效改善食物品质和色、香、味,但有 些物质严禁用作食品添加剂.下列做法正确的是( )
A.二氧化硫用作银耳的漂白剂B.胡萝卜素用作饮料的调味剂
C.次氯酸钠用作饼干的膨松剂D.苯甲酸钠用作火腿肠的防腐剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外小组利用干燥纯净H2还原黄色的WO3粉末并测定W的相对原子质量,如图是测定装置的示意图,A中的试剂是盐酸。
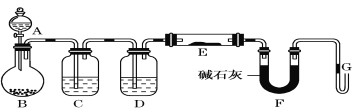
请回答下列问题。
(1)仪器B的名称是_____________。
(2)连接好装置后应首先检查气密性,其方法是____________________。
(3)检查气密性后,下列实验操作的先后顺序是(填字母)__________________。
a.加热玻璃管 b.从A瓶逐滴滴加液体 c. A瓶停止滴加液体
d.停止加热 e.检验氢气纯度
(4)已知取用WO3质量为a克,F的U形管实验前后质量分别为b克、c克,则钨的相对分子质量用字母表示为___________________________。
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体NO2(可以被碱完全吸收),在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色银单质。
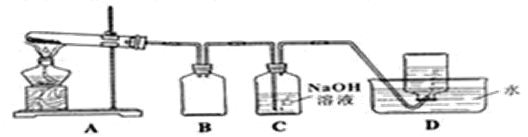
(5)给A中试管加热的方法是____________________。
(6)没有装置B可能出现的现象___________________________。
(7)有同学提出可以把B、C换成一个简单的装置,你认为可以是____________。
(8)同学们根据氧化还原反应知识讨论可以得出D中收集的气体成分。用实验证明该气体的方法是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氢气通入10 g 氧化铜粉末加热片刻,冷却后剩余固体的质量为8.4 g,下列计算正确的是
A. 有1.6 g 水生成
B. 有8.4 g 铜生成
C. 有80%的氧化铜被还原
D. 实验时所消耗的氢气不足0.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
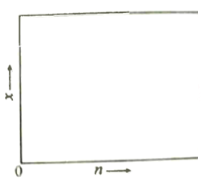
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
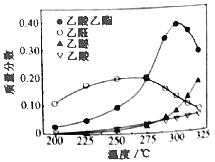
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)元素⑦的原子结构示意图为_____;元素⑩的名称为______;
(2)在这些元素中,化学性质最活泼的金属元素是____(填元素符号,下同),最不活泼的元素是___;原子半径最小的元素是_____;
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是___(填化学式,下同);具有两性的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
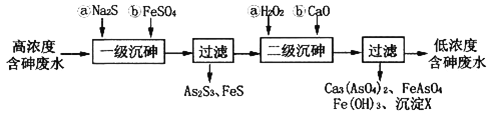
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为________________________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为______________________________________________________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________.
(5)步骤2的离子方程式为______________________________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com