
【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
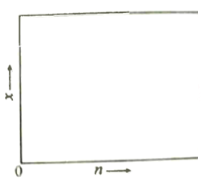
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
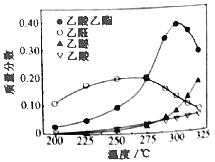
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
【答案】d 2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑ BC 0.67(或67%)
2(CH3)4NOH+H2↑+Cl2↑ BC 0.67(或67%)  使平衡正向进行,增大乙醇转化率,减少产品中乙醇含量 ACD
使平衡正向进行,增大乙醇转化率,减少产品中乙醇含量 ACD
【解析】
(一)根据电解原理分析电极发生的反应,得出电解总反应方程式;
(二)根据乙酸乙酯的合成原理,结合化学平衡原理分析即可。
(一)(1)以石墨为电极电解四甲基氯化铵溶液制备四甲基氢氧化铵,需要氢氧根离子,电解过程中阴极氢离子得到电子生成氢气,电解附近生成氢氧根离子,所以收集到(CH3)4NOH的区域是阴极区即d口。
故答案为:d;
(2)结合反应为和生成物的关系可知电解过程中生成产物为四甲基氢氧化铵、氢气和氯气,据此写出电解反应的化学方程式:2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑。
2(CH3)4NOH+H2↑+Cl2↑。
故答案为:2(CH3)4NCl+2H2O![]() 2(CH3)4NOH+H2↑+Cl2↑。
2(CH3)4NOH+H2↑+Cl2↑。
(二)(1)A项,酯化反应中浓硫酸具有催化作用和吸水作用,故A项不符合题意;
B项,反应过程中生成的乙酸乙酯为气体,反应前后熵变不为0,故B项符合题意;
C项,温度变化对反应速率影响较大,因为反应的△H接近于零,所以温度变化对平衡转化率的影响不大,故C项符合题意;
D项,压强对纯液体和固体影响不大,所以压强变化对该反应的化学平衡的影响可忽略不计,故D项不符合题意。
综上所述,本题正确答案为BC。
(2)设生成乙酸乙酯物质的量为x,则
CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l)
CH3COOC2H5(l)+H2O(l)
1 1 0 0
1-x 1-x x x
所以平衡常数K=![]() =4,X=0.667mol,则乙酸乙酯的平衡产率y=
=4,X=0.667mol,则乙酸乙酯的平衡产率y=![]() 100%=66.7%;
100%=66.7%;
乙酸和乙醇的物质的量之比,随乙酸的物质的量增加,乙酸乙酯的产量也会增加,当n:1=1:1时,乙酸乙酯的物质的量分数达到最大![]() ,乙酸的物质的量继续增大,乙酸乙酯物质的量分数反而逐渐减小图象如图所示:
,乙酸的物质的量继续增大,乙酸乙酯物质的量分数反而逐渐减小图象如图所示:

故答案为:66.7%; ;
;
(3)增大反应物的浓度使平衡向正反应方向进行,增加其他反应物转化率,所以控制乙酸过量的作用是使平衡正向进行,增大乙醇转化率,减少产品中乙醇含量,
故答案为:使平衡正向进行,增大乙醇转化率,减少产品中乙醇含量;
(4)A项,反应温度不宜超过300℃,若超过,图象分析可知乙酸乙酯质量分数降低,乙醚质量分数增加,故A项符合题意;
B项,反应物和生成物为液体,增大体系压强,对平衡影响不大,所以对提高乙醇平衡转化率影响不大,故B项不符合题意。
C项,在催化剂作用下,乙醇氧化为乙醛,乙醛被氧化为乙酸,乙醛是反应历程中的中间产物,故C项符合题意;
D项,工艺的关键是减少乙醚、乙烯等副产物,可以提高催化剂的活性和选择性,故D项符合题意。
综上所述,本题正确答案为ACD。


科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中分别发生可逆反应2A(g)+B(g)![]() 2C(s)和2NO2(g)
2C(s)和2NO2(g)![]() N2O4(g),以下标志反应一定达到平衡状态的正确个数是( )
N2O4(g),以下标志反应一定达到平衡状态的正确个数是( )
①混合气体的颜色不随时间而变化 ②各组分的物质的量浓度保持不变
③单位时间内反应物减少的质量等于生成物增加的质量
④压强不随时间的变化而变化
⑤混合气体的平均相对分子质量不随时间而变化
⑥各气体的体积分数不随时间而变化
A. 2个,5个B. 3个,5个C. 3个,4个D. 4个,6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,下列说法正确的是
A. 原子序数X<Y B. 原子半径X>Y
C. 原子的最外层电子数X>Y D. 元素的最高正价X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,商品供应商在包装袋中应放入的化学物质是( )
A.生石灰、蔗糖
B.硅胶(具有吸湿性)、硫酸亚铁
C.食盐、硫酸亚铁
D.生石灰、食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源的能量间接制取的能源称为二级能源。据此判断,下列叙述正确的是
A. 天然气是二级能源 B. 石油是二级能源
C. 电能是一级能源 D. 水力是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应:Z(?)+W(?)![]() X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
X(g)+Y(?)ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是( )
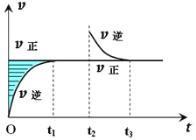
A. Z和W在该条件下至少有一个是为气态
B. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
C. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等
D. 若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(kJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
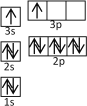
①某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了_________________。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为______。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由________________。
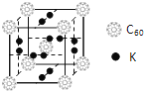
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为______。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
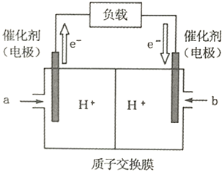
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N-H | N≡N |
键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com