
【题目】在一定温度下的恒容密闭容器中分别发生可逆反应2A(g)+B(g)![]() 2C(s)和2NO2(g)
2C(s)和2NO2(g)![]() N2O4(g),以下标志反应一定达到平衡状态的正确个数是( )
N2O4(g),以下标志反应一定达到平衡状态的正确个数是( )
①混合气体的颜色不随时间而变化 ②各组分的物质的量浓度保持不变
③单位时间内反应物减少的质量等于生成物增加的质量
④压强不随时间的变化而变化
⑤混合气体的平均相对分子质量不随时间而变化
⑥各气体的体积分数不随时间而变化
A. 2个,5个B. 3个,5个C. 3个,4个D. 4个,6个
【答案】A
【解析】
(1)在一定温度下的恒容密闭容器中,对于可逆反应2A(g)+B(g)![]() 2C(s)来说,是气体分子数减小的体系,则
2C(s)来说,是气体分子数减小的体系,则
①混合气体的颜色不随时间而变化不一定说明达到平衡状态,如A与B均为无色气体时,①项错误;
②因C为固体,则C的物质的量浓度保持不变,不能说明反应达到了平衡状态,②项错误;
③单位时间内反应物减少的质量等于生成物增加的质量,反应每一时刻均遵循质量守恒定律,不能说明反应达到了平衡状态,③项错误 ;
④压强不随时间的变化而变化,说明气体的分子数不变,则反应达到了平衡状态,④项正确;
⑤混合气体的总质量与总的物质的量之比在数值上等于其平均相对分子质量,对于该反应来说,混合气体的平均分子质量每一时刻均不随时间而变化,⑤项错误;
⑥各气体的体积分数不随时间而变化,是平衡状态的标志,⑥项正确;
综上所述,对于反应2A(g)+B(g)![]() 2C(s)来说,④⑥符合题意,故有2个一定可以说明反应达到了平衡状态;
2C(s)来说,④⑥符合题意,故有2个一定可以说明反应达到了平衡状态;
(2)同理可知,在一定温度下的恒容密闭容器中,对于可逆反应2NO2(g)![]() N2O4(g)来说,是气体分子数减小的反应,则
N2O4(g)来说,是气体分子数减小的反应,则
①因二氧化氮为红棕色气体,若混合气体的颜色不随时间而变化,说明各物质的浓度保持不变,则一定说明反应达到了平衡状态,①项正确;
②各组分的物质的量浓度保持不变,说明正逆反应速率相等,一定说明反应达到了平衡状态,②项正确;
③单位时间内反应物减少的质量等于生成物增加的质量,遵循质量守恒定律,不能说明反应达到了平衡状态,③项错误;
④该反应为气体分子数减小的反应,则压强不随时间的变化而变化,一定说明反应达到了平衡状态,④项正确;
⑤混合气体的总质量不随时间而变化,则平均相对分子质量不随时间而变化说明各物质的物质的量保持不变,一定说明反应达到了平衡状态,⑤项正确;
⑥各气体的体积分数不随时间而变化,一定说明反应达到了平衡状态,⑥项正确;
综上所述,对于反应2NO2(g)![]() N2O4(g)来说,①②④⑤⑥符合题意,故有5个一定可以说明反应达到了平衡状态,
N2O4(g)来说,①②④⑤⑥符合题意,故有5个一定可以说明反应达到了平衡状态,
答案选A。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
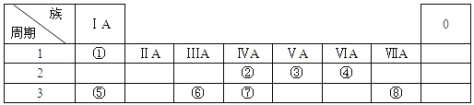
(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程___________
(2)④、②元素形成的化合物的结构式__________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____
(4)⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________
(5)由①③⑧组成的M 物质中所含化学键的类型_________________
(6)M中的阳离子的鉴定方法是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.镀锡的铁片镀层破损后,腐蚀速率加快
B.Fe在食盐水中被腐蚀,其负极反应为O2 +2H2O + 4e-=4OH-
C.可用被保护金属与直流电源负极相接的方法来减慢腐蚀速率
D.电解法精炼铜时,阳极材料应用粗铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
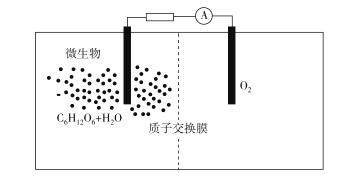
A. 负极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 正极反应式为O2+4e-+2H2O=4OH-
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,当前氮的氧化物的污染日趋严重,某企业处理该污染物的原理设计为燃料电池如图所示。在处理过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法不正确的是( )
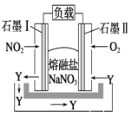
A. 该电池放电时电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极→熔融NaNO3→石墨Ⅰ电极
B. 石墨Ⅱ附近发生的反应:O2+4e-+2N2O5=4NO3-
C. O2在石墨Ⅱ附近发生还原反应,Y为N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
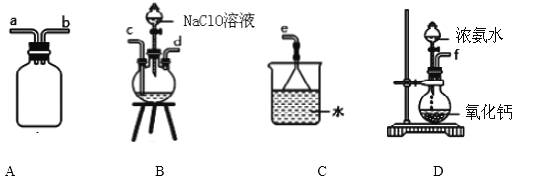
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关食品添加剂的说法中,正确的是( )。
A.山梨酸是一种常见的膨松剂
B.亚硝酸钠是一种常见的发色剂
C.碳酸氢钠具有碱性,是一种常见的调味剂
D.β胡萝卜素是一种人工食用色素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是:( )
A.加入硫酸铜溶液加快实验室制氢气的速率
B.硫酸铝溶液不能放在铁质容器中
C.用热的纯碱溶液去除油污
D.浓硫化钠溶液有硫化氢的气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

(1)收集到(CH3)4NOH的区域是________(填a、b、c或d)。
(2)写出电池总反应_____________。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l) ![]() CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法不合理的是_____________。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
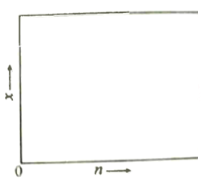
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_________;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)________。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有___________________。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_____。
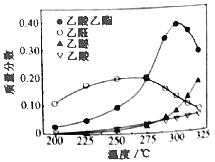
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com