
����Ŀ��ij�������õ�ⷨ����������ˮ�������������������������������ʢ�ź�����ˮ��ԭ��ʾ��ͼ���£�����˵������ȷ����
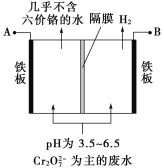
A��AΪ��Դ����
B����������Һ�з�����������ԭ��ӦΪ![]() +6Fe2++14H+===
+6Fe2++14H+===
2Cr3++6Fe3++7H2O
C��������������ҺpH����
D����������������ܽ⣬���ռ���H2 13.44 L(��״��)ʱ����0.1 mol ![]() ����ԭ
����ԭ
���𰸡�C
����������ͼ��֪B������H2��2H++2e��===H2����Ϊ������Ӧ����ü�����Һ��pH���ߣ����ӵ�Դ�ĸ�������A�����ӵ�Դ��������A����ȷ��C���������������Ӧ��Fe��2e��===Fe2+�����ɵ�Fe2+��![]() ��Ӧ��
��Ӧ��![]() +6Fe2++14H+===2Cr3++6Fe3++7H2O��B����ȷ������13.44 L H2��ת�Ƶ���1.2 mol�����ݵ����غ�����0.6 mol Fe2+���ɻ�ԭ0.1 mol
+6Fe2++14H+===2Cr3++6Fe3++7H2O��B����ȷ������13.44 L H2��ת�Ƶ���1.2 mol�����ݵ����غ�����0.6 mol Fe2+���ɻ�ԭ0.1 mol ![]() ��D��ȷ��
��D��ȷ��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���ֽ��ܼ��ŵ�����й����Ƴ�������̬������ȼ�ϵ�أ�SOFC�����õ�صĶ���ԭ����ͼ��ʾ������˵����ȷ���ǣ� �� 
A.���Ӵ�b������������a��
B.�����ĵ缫��ӦʽΪO2+4e��+2H2O�T4OH��
C.������ѡ��NaOH��������̬�����
D.����Ӧ��ת��1 mol���ӣ�������22.4L����״����CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���в���ȷ��������������
A��������ұ��ԭ������������������ԭ��Ӧԭ������һ�������½��������仯�����л�ԭ����
B��ұ������ʱ���������һ����������ԭ��
C�������ɻ���̬��Ϊ����̬��һ���DZ���ԭ
D���������ʱ����ֺ�Ӧ�õ�Խ�磬����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������-������ؾ��������ܶȸߵ��ŵ㣬������Ϊ����Դ�����ĵ�Դ����ṹ����ͼ��ʾ�����й�������ֻ����Li+ͨ��������˵����ȷ����
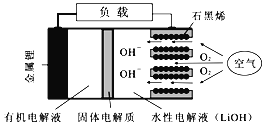
A. �ŵ�ʱ��������Ӧʽ��Li��e����OH��=LiOH
B. �ŵ�ʱ�������·����1 mol e��ת��ʱ��ˮ�Ե��Һ������������NA
C. Ӧ�øõ�ص��ͭ��������������64 g�������Ͻ�����11.2 L O2
D. Li+�������������������ƶ����õ�LiOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����ڽ������ʹ��Ե��ǣ�������
A.������B.��չ��C.���۵�D.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ŧ�۵�����ִ��������й㷺Ӧ�á���һ����п��أ���缫�ֱ���Ag2O��Zn���������ҺΪKOH��Һ���缫��ӦΪZn+2OH--2e-![]() Zn(OH)2��Ag2O+H2O+2e-
Zn(OH)2��Ag2O+H2O+2e-![]() 2Ag+2OH-�����������缫��Ӧ���ж�������������ȷ����
2Ag+2OH-�����������缫��Ӧ���ж�������������ȷ����
A����ʹ�ù����У���ظ�������Һ��pH����
B����ʹ�ù����У�������Ag2O�������·����Zn��
C��Zn�缫������ԭ��Ӧ��Ag2O�缫����������Ӧ
D��Zn�Ǹ�����Ag2O������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ�������ͼ�и�������Ϣ��ָ�������й�˵������ȷ���ǣ�������Ϊ���ϼ۵ı仯��������Ϊԭ�������ı仯���� �� 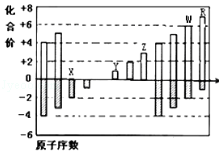
A.ԭ�Ӱ뾶��W��Z��Y
B.��̬�⻯����ȶ��ԣ�H2X��H2W
C.Y2X��ˮ��Ӧ���������ӻ�����
D.Y��Z�����������Ӧ��ˮ���ﲻ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����̶�װ��H2��CO��CO2���������ܱ������������м��������Na2O2���������õ��ȼʹ���ַ�Ӧ����Ӧ������ָ�����ʼ�¶ȣ���������ڵ�ѹǿ������������Բ��ƣ�����ʼ״̬��1/4����ԭ��������ƽ����Է�������������
A. 20g/mol B. 23g/mol C. 30g/mol D. 36g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��������������Ԫ���У�ȫ��������Ԫ�ص�һ���ǣ�������
A.11 22 26B.13 15 38C.16 29 31D.18 21 31
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com