
【题目】新型锂-空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如右图所示,其中固体电解质只允许Li+通过。下列说法正确的是
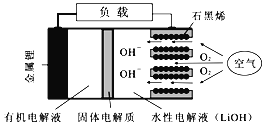
A. 放电时,负极反应式:Li-e-+OH-=LiOH
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
【答案】D
【解析】A项,负极区为有机电解液,没有OH-,故A错误;B项,放电时,当外电路中有1 mol e-转移时,负极产生1molLi+(NA个),通过固体电解质进入水性电解液,同时正极发生反应:O2+2H2O+4e-=4OH-,生成1molOH-(NA个)进入水性电解液,所以水性电解液离子总数增加2NA,故B错误;C项,应用该电池电镀铜,阴极反应:Cu2++2e-= Cu,阴极质量增加64 g,则生成1molCu,电路中通过2mol电子,理论上原电池正极消耗0.5mol氧气,在标准状况下体积为11.2L,非标准状况不一定是11.2L,故C错误;D项,负极生成Li+,正极生成OH-,原电池中阳离子向正极移动,由已知固体电解质只允许Li+通过,所以Li+穿过固体电解质向正极移动而得到LiOH溶液,故D正确。


科目:高中化学 来源: 题型:
【题目】图为一原电池装置,下列叙述中正确的是
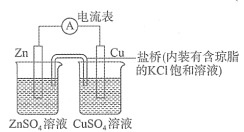
A.该装置中电子由Zn电极流向Cu电极,溶液中的![]() 通过盐桥移向Zn极
通过盐桥移向Zn极
B.将上述装置中的Zn棒和Cu棒同时浸入CuSO4溶液,电流表的指针偏转幅度变小,且很快减弱
C.将烧杯内溶液对换,电流表指针发生偏转
D.将盐桥改为铜导线连接两种溶液,电流由Cu电极移向Zn电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是理想的清洁能源。科学家通过化学方法使能量按人们所期望的形式转化,从而提高能源的利用率。
(1)氢气在燃烧时,放出大量热量,说明该反应是____反应(填“放热”或“吸热”);这是由于反应物的总能量___生成物的总能量(填“大于”或“小于”);从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量________形成产物的化学键放出的总能量(填“大于”或“小于”)。
(2)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,如图就是能够实现该转化的装置,被称为氢氧燃料电池。

该电池的正极是_____(填“a电极”或“b电极”),在负极发生的电极反应式是_________________。电池反应的总方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】区别乙醛、甲苯、和溴苯,最简单的方法是( )
A.加硝酸银溶液后振荡
B.加蒸馏水后振荡,静置
C.与新制Cu(OH)2悬浊液共热
D.加酸性高锰酸钾溶液后振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2两种同分异构体
C—CH=CH2两种同分异构体
D. 芳香烃![]() 和
和![]() 的一氯代物都只有2种
的一氯代物都只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO2和H2催化氢化可以制取甲烷。
(1)已知 ①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH= -572 kJ·mol-1
③H2O(l)=H2O(g) ΔH= +44 kJ·mol-1
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=a kJ·mol-1
CH4(g)+2H2O(g) ΔH=a kJ·mol-1
据此,a=_________;升高温度,该反应的v(逆)_____(填“增大”或“减小”)。
(2)在一定压强、不同温度下,两种催化剂分别催化CO2加氢甲烷化反应2h的结果如图1所示(一定温度下仅改变催化剂,其他条件不变):a、b-催化剂I; c、d-催化剂II。甲烷化选择性:指含碳产物中甲烷的物质的量分数。请据图1分析:
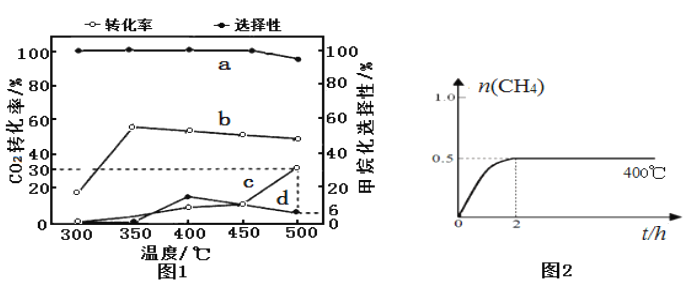
①催化剂I实验,400 ℃~450℃时CO2转化率下降的原因可能为___________(写1条)。
②催化剂II实验,检测密闭容器中产物发现,温度升高甲烷的选择性下降是发生了:CO2(g)+ H2(g)![]() CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
(3)下列与甲烷化反应有关的描述中,正确的是______:
A.单位时间内断裂1molC=O键的同时断裂1molC-H,说明该反应已达平衡
B.照上述反应使用催化剂,其Ⅰ的活化能比Ⅱ的活化能大
C.在绝热的密闭容器中进行时,当容器中温度不变时说明达到平衡
D.催化剂Ⅰ下,300-450℃内,选择性保持不变的主要原因是其它副反应的速率很慢
(4)催化剂I实验, 400℃时,向2L固定体积的密闭容器中通入1mol CO2和4mol H2,CH4物质的量随时间的变化趋势如图2时所示,则2h内H2平均反应速率为____________;平衡常数K=____________。若其他条件不变,反应在恒压条件下进行,请在图2中画出反应体系中n(CH4)随时间t变化的趋势图____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
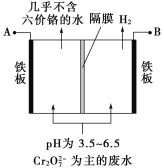
A.A为电源正极
B.阳极区溶液中发生的氧化还原反应为![]() +6Fe2++14H+===
+6Fe2++14H+===
2Cr3++6Fe3++7H2O
C.阴极区附近溶液pH降低
D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol ![]() 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属Na的叙述中,说法正确的是
A. Na在空气中燃烧,发出黄色火焰 B. Na在空气中燃烧,产物是Na2O
C. Na是银白色金属,硬度大,熔点高 D. Na常温和加热时反应,产物一样
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com