
【题目】下列措施不符合“绿色化学”思想的是
A.循环使用物料 B.用水代替有机溶剂
C.直接排放电镀废水 D.发展原子利用率达到100%的化学反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如右图所示,其中固体电解质只允许Li+通过。下列说法正确的是
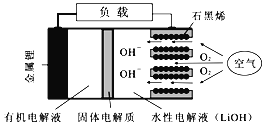
A. 放电时,负极反应式:Li-e-+OH-=LiOH
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一体积固定装有H2、CO、CO2混合气体的密闭容器,向其中加入过量的Na2O2,并不断用电火花点燃使其充分反应,反应结束后恢复至起始温度,测得容器内的压强(固体体积忽略不计)是起始状态的1/4。则原混合气体的平均相对分子质量可能是
A. 20g/mol B. 23g/mol C. 30g/mol D. 36g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015江苏][双选]在体积均为1.0 L的两恒容密闭容器中加入足量的相同的炭粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A.反应CO2(g)+C(s)![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是一种日常生活中常见的金属,它既能与盐酸反应生成X3+和H2,又能与烧碱溶液反应生成XO2-和H2O.X的氢氧化物具有两性,但不与氨水反应;而Zn(OH)2与氨水反应生成[Zn(NH3)4]2+.试回答下列问题:
(1)X元素在元素周期表中的位置是______。
(2)X的氧化物也具有两性,写出其溶于烧碱溶液的离子方程式:_______。
(3)分离X3+与Zn2+的最佳方法是加入过量的____________。
(4)与O同周期的第VA族元素Z形成的最常见氢化物也可表示为ZH3,Z还可形成多种氢化物及其微粒,如Z2H4、Z2H5+、ZH4+等.
①写出Z2H4的电子式:________。
工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(Z2H4·H2O)、Na2CO3等产物,则该反应的化学方程式为_________。
查资料得,在高温下肼可将锅炉内壁表面的铁锈转化为致密的氧化膜。取3.2g肼与96g该铁锈样品(可看作是Fe2O3)在搞完下恰好完全反应生成氮气等产物,写出该反应的化学方程式:_______。
②若某一物质组成为Z4H4,则它的一种离子化合物的化学式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 molL-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(3)步骤③中判断滴定终点的方法是 。
(4)通过计算确定铁钾矾的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com