
����Ŀ����֪AΪ����ɫ���壬R�ǵؿ��к������Ľ���Ԫ�صĵ��ʣ�TΪ������ʹ����㷺�Ľ������ʣ�D �Ǿ��д��Եĺ�ɫ���壬C��F����ɫ��ζ�����壬H�ǰ�ɫ������W��Һ�еμ�KSCN��Һ���ֺ�ɫ��
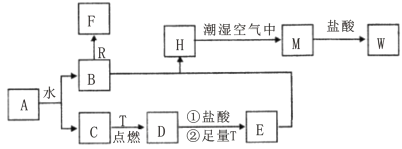
(1)����D�Ļ�ѧʽΪ___________��E��ѧʽΪ___________��
(2)��ȼ����Fǰ������___________________________��
(3)H�ڳ�ʪ�����б��M��ʵ��������______________________________________________����ѧ����ʽΪ_________________________________��
(4)B��R����Һ�з�Ӧ����F�����ӷ���ʽΪ___________________________________��
���𰸡�Fe3O4 FeCl2 �������崿�� ��ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ 4Fe(OH)2+2H2O+O2=4Fe(OH)3 2Al+2OH+2H2O=2AlO2��+3H2��
��������
����ת����ϵ�ͷ�Ӧ������AΪ����ɫ����������ˮ��Ӧ������AΪNa2O2��TΪ������ʹ����㷺���Ľ������ʣ���TΪFe��R�ǵؿ��к������Ľ���Ԫ�صĵ��ʣ���RΪAl��D�Ǿ��д��Եĺ�ɫ���壬��DΪFe3O4��C��F����ɫ��ζ�����壬H�ǰ�ɫ������W��Һ�еμ�KSCN��Һ���ֺ�ɫ����W���������ӣ�����������ˮ��Ӧ����B��C������C��Ӧ����Fe3O4������CΪO2��BΪNaOH��D�����ᷴӦ��������Ӧ���ɵ�EΪFeCl2��B��E��Ӧ����HΪFe��OH��2��H�볱ʪ�Ŀ�����Ӧ���ɵ�MΪFe��OH��3��M�����ᷴӦ���ɵ�WΪFeCl3��C��F����ɫ��ζ�����壬��������������Ӧ���ɵ�FΪH2���ݴ˴��⡣
��1����������ķ�����֪��DΪFe3O4��EΪFeCl2��
�ʴ�Ϊ��Fe3O4��FeCl2��
��2������FΪH2�������Ϳ��������һ���ķ�Χ�ڵ�ȼ�ᷢ����ը����ȼH2ǰ�����ȼ������崿�ȣ�
�ʴ�Ϊ���������崿�ȣ�
��3��Fe��OH��2�ڳ�ʪ�����б��Fe��OH��3��ʵ������Ϊ����ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ����Ӧ�Ļ�ѧ����ʽΪ��4Fe��OH��3+O2+2H2O=4Fe��OH��3���ʴ�Ϊ����ɫ����Ѹ�ٱ�Ϊ����ɫ�����ձ�Ϊ���ɫ��4Fe��OH��3+O2+2H2O=4Fe��OH��3��
��4��NaOH��Al��Ӧ����H2�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2�����ʴ�Ϊ��2Al+2OH-+2H2O=2AlO2-+3H2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M���ֶ�����Ԫ�أ����������ڱ���λ����ͼ��ʾ������˵����ȷ����
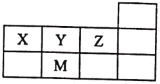
A. ԭ�Ӱ뾶��M��Z��Y��X
B. Z����̬�⻯�����ȶ���������Ӽ�������
C. ����������Ӧˮ���������M��Z
D. Ԫ�صķǽ����ԣ�X��Y��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� �ߴ���������Ϊ�ϳ���������Ԫ�������ϵ�ԭ�ϣ���ҵ�Ͽ�����Ȼ�������̷������̿���Fe��Al��Mg��Zn��Ni��Si��Ԫ�أ��Ʊ�����������ͼ��ʾ���ش��������⣺
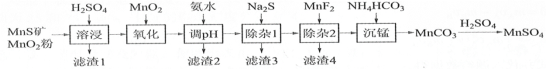
��ؽ�������[c0(Mn+)=0.1 mol��L1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
��ʼ������pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
������ȫ��pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
��1��������1������S��________________��д�����ܽ����ж������������̷�Ӧ�Ļ�ѧ����ʽ_______��
��2����������������������MnO2�������ǽ�________________________��
��3������pH��������������Һ��pH��ΧӦ����Ϊ_______~6֮�䡣
��4��������1����Ŀ���dz�ȥZn2+��Ni2+��������3������Ҫ�ɷ���______________��
��5��������2����Ŀ��������MgF2������ȥMg2+������Һ��ȹ��ߣ�Mg2+��������ȫ��ԭ����______
��6��д���������������ӷ���ʽ_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ����(����)
A.8.7 g MnO2��40 mL 10 mol��L��1��Ũ�����ַ�Ӧ�����ɵ������ķ�����Ϊ0.1NA
B.���³�ѹ�£�Cu��Znԭ����У���������1.12 L H2ʱ��ת�Ƶĵ�����ӦΪ0.1NA
C.����3NA�����ӵ�Na2O2��������ˮ���1 L��Һ��������Һ��Na����Ũ��Ϊ2 mol��L��1
D.1.0 L 1.0 mol��L��1��NaAlO2ˮ��Һ�к��е���ԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Һϳɳ���һ���»������ͼ��ʾ��������W��X��Y��ZΪͬһ������Ԫ�أ�Z����������������X�����������һ�롣����������ȷ����

A. WZ��ˮ��Һ�ʼ���
B. Ԫ�طǽ����Ե�˳��ΪX>Y>Z
C. Y������������ˮ��������ǿ��
D. ���»�������Y������8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Կ�ȸʯ[��Ҫ�ɷ���CuCO3��Cu(OH)2����������������FeO��Fe2O3��SiO2]Ϊԭ���Ʊ�CuSO4��5H2O�������£�
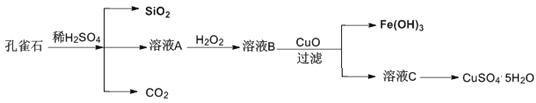
��ش��������⣺
��1����ҺA�Ľ���������Fe3+��______________��
��2����ҺA�м���H2O2��Ŀ����______________�����������ӷ���ʽΪ_____________________��
��3������ҺC���CuSO4��5H2O����Ҫ��������������______________�����˵Ȳ�����
��4����ҺB��CuO��Ӧ����Fe(OH)3����ҺC�Ļ�ѧ����ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijҽҩ�м���G��һ�ֺϳ�·�����£�
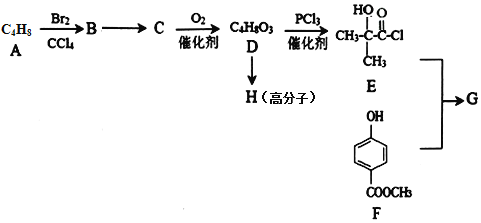
��֪��(1)A(C4H8)�ĺ˴Ź��������������,�ҷ����֮��Ϊ3��1��D�ķ���ʽΪ(C4H8O3)
(2)G�Ľṹ��ʽΪ��![]() ��
��
�ش��������⣺
(1)B��C�ķ�Ӧ������______��
(2) G �ķ���ʽΪ______��G�й�����������______��1molG��NaOH��Һ��Ӧ�������______molNaOH��
(3)H�Ľṹ��ʽΪ______��
(4)D��Ũ������ȵ������»�����һ�ֺ���Ԫ���Ļ�����,д���÷�Ӧ�Ļ�ѧ����ʽ��_____��
(5)I��F��Ϊͬ���칹��,����������������I�Ľṹ��______��(������F)��
��������������ȡ����������FeCl3��Һ����ɫ��������NaOH��Ӧ��
(6)��������������Ϣ,д���ɱ��ӡ��ױ�Ϊԭ���Ʊ������ᱽ�����ĺϳ�·�ߣ���֪��RCOOH![]() RCOCl��
RCOCl��![]() �������Լ���ѡ����______��
�������Լ���ѡ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ý�����෨��ʾ��һЩ���ʻ����֮��Ĵ����������ϵ������ȷ����( )
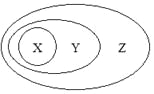
X | Y | Z | |
A | CuSO4��5H2O | �� | ������ |
B | ���� | ��ɢϵ | ����� |
C | ���������� | ������ | ������ |
D | �û���Ӧ | ������ԭ��Ӧ | ���ӷ�Ӧ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������仯��������ʣ�������Ч������������滷������Ԫ�ػ��ϼ�������������ϵͼ���¡�
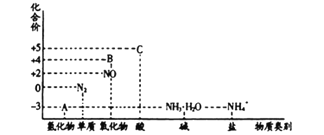
�ش���������:
(1)�ڴ����ͼ��ȵ������£�����A����NO�ǹ�ҵ���������Ҫ��Ӧ����ѧ����ʽ�ǣ�__________
(2)�ڼ��������£�����C��Ũ��Һ��̼���ʷ�Ӧ��д����Ӧ�Ļ�ѧ����ʽ: _______________��
(3)ʵ�����У�������Һ�к���NH4+�IJ���������: __________________________��
(4)����BΪ����ɫ���壬д����������ˮ��Ӧ�����ӷ���ʽ_____________������Ӧ����3.36L (��״��) ����Bʱ��ת�Ƶ��ӵ����ʵ���Ϊ__________________________��
(5)��32gͭ��140 mLһ��Ũ�ȵ�C��Һ��Ӧ��ͭ��ȫ�ܽ�����������ڱ�״���µ����Ϊ11.2L��
�ٲμӷ�Ӧ��C�����ʵ���Ϊ__________________________��
�ڴ�����������ȫ���ͷź�����Һ�м���VmLamol��L-1 ��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת���ɳ�������ԭC��Һ��Ũ��Ϊ________ mol��L-1
����ʹͭ��C��Ӧ���ɵ�������NaOH��Һ��ȫ��ת��ΪNaNO3��������Ҫͨ��O2_____mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com