
【题目】某医药中间体G的一种合成路线如下:
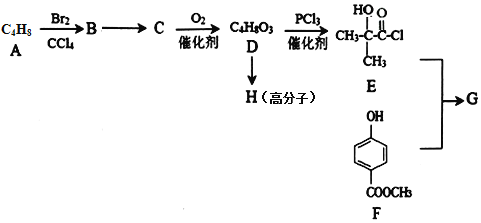
已知:(1)A(C4H8)的核磁共振氢谱有两组峰,且峰面积之比为3:1;D的分子式为(C4H8O3)
(2)G的结构简式为:![]() ;
;
回答下列问题:
(1)B→C的反应类型是______。
(2) G 的分子式为______;G中官能团名称是______;1molG与NaOH溶液反应最多消耗______molNaOH。
(3)H的结构简式为______。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式:_____。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚、甲苯为原料制备苯甲酸苯酚酯的合成路线,已知:RCOOH![]() RCOCl(
RCOCl(![]() 其它无机试剂任选):______。
其它无机试剂任选):______。
【答案】水解反应或取代反应 ![]() 酯基、羟基 3
酯基、羟基 3 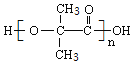
![]()
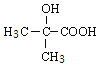
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
由题意可知,A(C4H8)的核磁共振氢谱有两组峰,且峰面积之比为3:1,故A为![]() ,与Br2发生加成反应得到B
,与Br2发生加成反应得到B 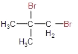 ,B发生水解反应或者取代反应得到C,C为
,B发生水解反应或者取代反应得到C,C为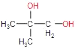 ,发生氧化反应后得到D
,发生氧化反应后得到D  ,D继续进行反应发生缩聚反应得到H
,D继续进行反应发生缩聚反应得到H 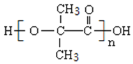 ,D发生取代反应得到E,E与F发生取代反应生成G,G为
,D发生取代反应得到E,E与F发生取代反应生成G,G为![]() ,根据此分析进行解答。
,根据此分析进行解答。
(1)结合以上分析可知,B为 ,B发生水解反应或者取代反应得到C
,B发生水解反应或者取代反应得到C  。
。
故答案为; 水解反应或取代反应;
(2)G的结构简式为![]() ,由结构简式可知G的分子式为
,由结构简式可知G的分子式为![]() ,G中含有两个酯基和一个羟基,所以1molG水解得到1mol羧基和2mol羟基,与NaOH溶液反应最多消耗3molNaOH溶液。
,G中含有两个酯基和一个羟基,所以1molG水解得到1mol羧基和2mol羟基,与NaOH溶液反应最多消耗3molNaOH溶液。
故答案为: ![]() ;酯基、羟基; 3;
;酯基、羟基; 3;
(3)D 为 继续进行反应发生缩聚反应可得到H
继续进行反应发生缩聚反应可得到H  。
。
故答案为 
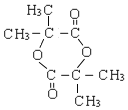
(4)D在浓硫酸加热的条件下会发生酯化反应,生成一种含六元环的环状酯,反应方程式为![]()
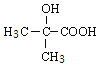
![]()
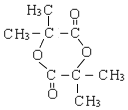
![]() ;
;
故答案为: ![]()
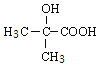
![]()

![]()
(5)由要求可知①苯环上有两个取代基②遇FeCl3溶液显紫色,则其中一个取代基为酚羟基③能与NaOH反应,则含有羧基或酯基。即有HOC6H4COOCH3(邻、间)、HOC6H4CH2OOCH(邻、间、对)、 HOC6H4CH2OOCCH3 (邻、间、对)、HOC6H4CH2COOH(邻、间、对)共有11种同分异构体,
故答案为 :11;
(6)根据RCOOH![]() RCOCl,先将甲基苯酸化氧化为苯甲酸,之后与PCl3反应,最后与苯酚反应制备出苯甲酸苯酚酯。合成路线为
RCOCl,先将甲基苯酸化氧化为苯甲酸,之后与PCl3反应,最后与苯酚反应制备出苯甲酸苯酚酯。合成路线为![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。
故答案为 ![]()
![]()
![]()
![]()
![]()
![]()
![]()


科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20 g·mL-1。
(1)此浓盐酸中HCl的物质的量浓度是________。
(2)配制100 mL该浓盐酸,需要标准状况下HCl的体积为________。
(3)配制100 mL 3.00 mol·L-1的盐酸,需以上浓盐酸的体积为________。
(4)将10.0 mL 3.00 mol·L-1的盐酸与10.0 mL 1.00 mol·L-1的MgCl2溶液混合,则混合溶液中Cl-的物质的量浓度是________。(设混合后溶液的体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是

A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D 是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色。
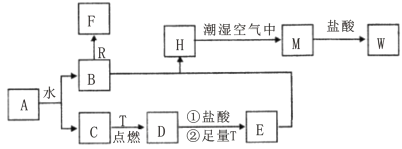
(1)物质D的化学式为___________,E化学式为___________。
(2)点燃气体F前必须先___________________________。
(3)H在潮湿空气中变成M的实验现象是______________________________________________,化学方程式为_________________________________。
(4)B和R在溶液中反应生成F的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
B.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
C.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
D.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
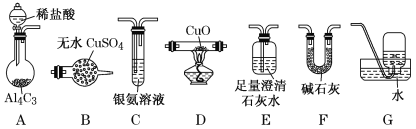
[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-=2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+=Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___。
(2)按气流方向各装置从左到右的连接顺序为A→__。(填字母编号)
(3)已知气体产物中含有CO,则装置C中可观察到的现象是___装置F的作用为__。
(4)当反应结束后,装置D处试管中固体全部变为红色。设计实验证明红色固体中含有Cu2O:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的主要因素是

①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④ B. ③④ C. ①③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为__________(该溶液密度约为 1.0 g/cm3)。
(2)该注射液中葡萄糖的物质的量浓度是__________mol/L(计算结果精确到小数点后2位)。
(3)某同学进行某项实验需要480 mL上述葡萄糖溶液,其配制过程如下,请完成填空:
①该同学需称取________g葡萄糖在烧杯中溶解;
②配制时,正确的操作顺序是(用字母表示,每个字母只能用一次)________;
A.用50 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称取葡萄糖并加入盛有少量水(约50 mL)的烧杯中,用玻璃棒慢慢搅拌,使其完全溶解
C.将已溶解完全的葡萄糖溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面的最底处恰好与刻度线相切
F.继续往容量瓶内小心加水,至液面离容量瓶颈刻度线下1~2 cm 处
③在配制过程中,下列实验操作使所配制的葡萄糖溶液的物质的量浓度偏高的是________(填字母代号);
A.用托盘天平称取葡萄糖时“左物右码”
B.溶解时使用的烧杯和玻璃棒未洗涤
C.洗净的容量瓶未经干燥就用于配制溶液
D.定容时俯视凹液面
E.加水超过刻度线后,用胶头滴管吸出多余的液体
(4)已知溶液中某溶质的物质的量除以溶剂的质量称为该溶质的质量摩尔浓度,单位为mol/kg。
①上述葡萄糖溶液的质量摩尔浓度为________(计算结果精确到小数点后2位)mol/kg。
②若将标准状况下a L HCl气体完全溶于b g水中,此时该盐酸的质量摩尔浓度为______(只需列出计算式,无需化简)mol/kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com