
【题目】已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
B.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
C.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
D.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
【答案】B
【解析】
根据题意知:燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ。
A. 由物质的物质的量与反应放出的热量成正比可知,生成4mol二氧化碳气体和1mol液态水,并放出热量4bkJ,乙炔燃烧热可燃物的系数要求必须是1mol,故A错误;
B. 由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和1mol液态水,并放出热量2bkJ,△H=-2bkJ/mol表示放出热量,故B正确;
C. 由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和1mol液态水,并放出热量2bkJ,△H=+2bkJ/mol表示吸收热量,故C错误;
D. 由物质的物质的量与反应放出的热量成正比可知,生成4mol二氧化碳气体和1mol液态水,并放出热量4bkJ,则乙炔燃烧的热化学方程式为2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l);△H=-4bkJ/mol,故D错误;
正确答案是B。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】(1)按![]() X(X为元素符号)格式写出含有8个质子、10个中子的原子的化学符号:_________。
X(X为元素符号)格式写出含有8个质子、10个中子的原子的化学符号:_________。
(2)根据下列微粒回答问题:![]() H、
H、![]() H、
H、![]() H、14C、14N、16O、35Cl2、37Cl2。
H、14C、14N、16O、35Cl2、37Cl2。
①以上8种微粒共有________ 种核素,共________ 种元素。
②互为同位素的是________ 。
③质量数相等的是________ 和________ ,中子数相等的是________ 和________ 。
(3)相同物质的量的14CO2与S18O2的质量之比为________;电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
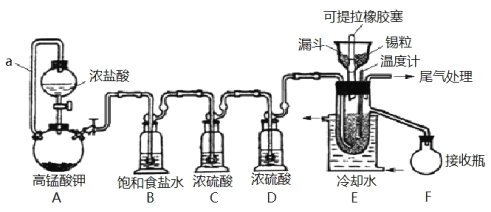
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
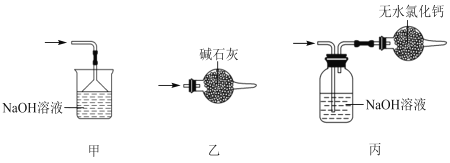
(5)尾气处理时,可选用的装置是___(填序号)。
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是
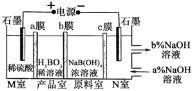
A.b膜为阴离子交换膜
B.阳极的电极反应式为:2H2O-4e- = O2↑+4H+
C.N室中:a%<b%
D.理论上每生成1mol产品,阴极室可生成5.6L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体G的一种合成路线如下:
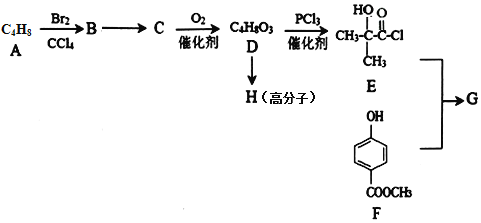
已知:(1)A(C4H8)的核磁共振氢谱有两组峰,且峰面积之比为3:1;D的分子式为(C4H8O3)
(2)G的结构简式为:![]() ;
;
回答下列问题:
(1)B→C的反应类型是______。
(2) G 的分子式为______;G中官能团名称是______;1molG与NaOH溶液反应最多消耗______molNaOH。
(3)H的结构简式为______。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式:_____。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚、甲苯为原料制备苯甲酸苯酚酯的合成路线,已知:RCOOH![]() RCOCl(
RCOCl(![]() 其它无机试剂任选):______。
其它无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1
②2H2(g)+O2(g) =2H2O(g) ΔH=-483.6 kJ·mol-1
则制备水煤气的反应C(s)+H2O(g) =CO(g)+H2(g) ΔH为( )
A.+262.6 kJ·mol-1B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1D.+131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaC1O2的实验流程如图所示,反应I的化学方程式为: 3NaC1O3+4SO2+3H2O=2C1O2+Na2SO4+3H2SO4+NaCl,下列说法正确的是
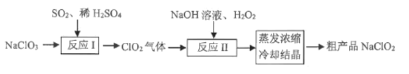
A.NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H2O2做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池充放电时的总反应:![]() ,下列有关该电池的说法不正确的是( )
,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为![]()
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com