
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
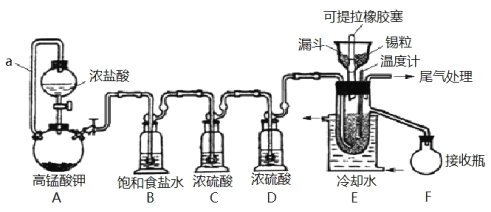
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
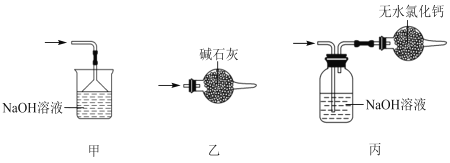
(5)尾气处理时,可选用的装置是___(填序号)。
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶
【答案】平衡压强,使浓盐酸顺利流下 2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O 除去氯气中混有的氯化氢气体 避免四氯化锡气化而损失,导致产率下降 乙 CuCl2熔点较高,不会随四氯化锡液体溢出 A、C
【解析】
SnCl4极易水解,反应应在无水环境下进行进行,装置A:采用KMnO4和浓盐酸反应的方法制取Cl2,反应还生成MnCl2,发生2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O,制取的氯气中含有氯化氢,通过饱和的氯化钠溶液洗去氯气中的氯化氢,SnCl4在空气中极易水解,利用浓硫酸的吸水性干燥氯气,防止产生SnCl4水解;然后Cl2和锡的反应,制备SnCl4,冷水冷却,可将气态的SnCl4冷凝回流收集产物;反应时应先生成氯气,将氧气排出。
(1)导管a的作用是平衡压强,可使分液漏斗内的液体顺利流下,故答案为:平衡压强,使浓盐酸顺利流下;
(2)实验采用KMnO4和浓盐酸反应的方法制取Cl2,反应还生成MnCl2,化学方程式为2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O,故答案为:2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O;
(3)B的作用是除去氯气中混有的氯化氢气体,故答案为:除去氯气中混有的氯化氢气体;
(4)SnCl4易挥发,冷水可降低温度,避免四氯化锡气化而损失,导致产率下降,故答案为:避免四氯化锡气化而损失,导致产率下降;
(5)尾气含有氯气,为避免四氯化锡水解,应用碱石灰,故答案为:乙;
(6)锡粒中含铜杂质致E中产生CuCl2,但不影响F中产品的纯度,原因是CuCl2熔点较高,不会随四氯化锡液体溢出,故答案为:CuCl2熔点较高,不会随四氯化锡液体溢出;
(7)蒸馏用到蒸馏烧瓶、温度计、接收器、冷凝管、锥形瓶,无需吸滤瓶和分液漏斗,故答案为:A、C。


科目:高中化学 来源: 题型:
【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,其制备原理为:![]()
甲、乙两同学分别设计了如下装置来制备乙酸乙酯。

请回答下列问题:
(1)下列说法不正确的是________。
A.加入试剂的顺序依次为乙醇、浓硫酸、乙酸
B.饱和碳酸钠的作用是中和乙酸、溶解乙醇、促进乙酸乙酯在水中的溶解
C.浓硫酸在反应中作催化剂和吸水剂,加入的量越多对反应越有利
D.反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,待液体分层后即可从上口倒出上层的乙酸乙酯
(2)乙装置优于甲装置的理由是________。(至少说出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉的主要成分是次氯酸钙和氯化钙。请回答下列问题:
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):____________________________。
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为_____________(假设漂白粉中的其它成份不与硝酸反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料,工业上由N2和H2在一定条件下合成。
(1)已知H2的标准燃烧热为△H1=-akJ·mol-1,NH3的标准燃烧热为△H2=-bkJ·mol-1。则合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的△H3=_________ kJ·mol-1 (用含a、b的代数式表示)。
2NH3(g)的△H3=_________ kJ·mol-1 (用含a、b的代数式表示)。
(2)合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g)在一定温度下能自发进行,则△H3______0(填“>”或“<”),原因是__________。
2NH3(g)在一定温度下能自发进行,则△H3______0(填“>”或“<”),原因是__________。
(3)一定温度下,向体积为2L的密闭容器中通入一定量的N2和H2反生反应,有关物质的量随反应时间的变化如图所示。该温度下,反应的平衡常数为_________________。
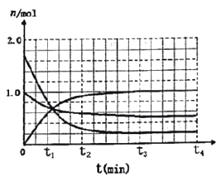
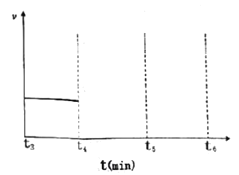
若在t4时刻,同时向体系中再通入0.5 mol N2和1moNH3,t5时刻重新达到平衡,请在下图中画出t4~t6时间段逆反应速率随时间的变化图_____________。
(4)文献报道,常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质可在电极上直接生成氨气。阴极的反应方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体;实验②、③中红色均不褪去。下列分析错误的是

A. 过氧化钠与水反应产生的气体为O2
B. 过氧化钠与水反应需要MnO2作催化剂
C. 实验②、③证明使酚酞褪色的不是氢氧化钠和氧气
D. 过氧化钠与水反应可能生成了具有漂白性的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
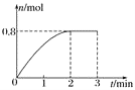
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔(C2H2)气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则表示乙炔燃烧热的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(g) ΔH=-4b kJ·mol-1
B.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
O2(g) =2CO2(g)+H2O(l) ΔH=-2b kJ·mol-1
C.C2H2(g)+![]() O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
O2(g) =2CO2(g)+H2O(g) ΔH=+2b kJ·mol-1
D.2C2H2(g)+5O2(g) =4CO2(g)+2H2O(l) ΔH=+4b kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是以海水为原料,获得某产物的工艺流程图。已知在吸收塔中,溶液的pH显著减小。试回答下列问题:

(1)图中两次氯化的作用是否相同________(选填“是”或“否”)。
(2)吸收塔中反应的化学方程式为_______________________________,第2次氯化的离子方程式为_________________________________________________。
(3)资料证实,在酸性介质中,第1次氯化过程中可用氧气或空气替代。但在实际工业生产中为什么不用更廉价的空气替代氯气________________________。
(4)本工艺的处理方法可简单概括为“空气吹出、X气体吸收、氯化”。某同学认为在工业生产过程中对第1次氯化液直接蒸馏也可得到产物,不必进行上述过程,请对该同学的说法作出正确的评价___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com