
【题目】在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+、K+、SO42﹣、HCO3﹣
B.Na+、K+、Cl、SO42﹣
C.Cu2+、K+、SO42﹣、NO3﹣
D.Fe2+、K+、NO3﹣、Cl
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
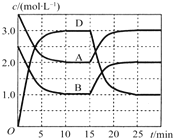
A.反应在前10min的平均反应速率v(B)=0.15mol/( L ·min)
B.该反应的平衡常数表达式K=![]()
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98KJ。在含有少量I![]() 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
① H2O2+ I![]()
![]() H2O+IO
H2O+IO![]() (慢)②H2O2+ IO
(慢)②H2O2+ IO![]()
![]() H2O+O2+ I
H2O+O2+ I![]() (快)
(快)
下列有关该反应的说法正确的是
A. 反应速率与I![]() 浓度有关 B. IO
浓度有关 B. IO![]() 也是该反应的催化剂
也是该反应的催化剂
C. 该化学反应速率由反应②决定 D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

①该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响: 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生的化学反应方程式 _______________ ______。
②实验结果说明催化剂作用的大小与________ _________ 有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).
A ![]() B
B ![]() C
C
试回答:
(1)若X为O2,则A不可能是______(填选项)
a.NH3 b.Mg c.S d.Si
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因____________________,举出C的一种用途_____________________
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式__________________C的水溶液中各离子浓度由大到小顺序为_______________________.
(4)若A为单质,C为红棕色气体。写出少量Fe粉与组成A物质的元素的最高价氧化物的水化物的稀溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是
A. 浓盐酸具有氧化性,可作为实验制氯气的原料 B. SO2具有还原性,可用来漂白品红
C. NH3具有碱性, 可用氨水吸收硫酸厂尾气 D. 氢氟酸具有酸性,可用于雕刻玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
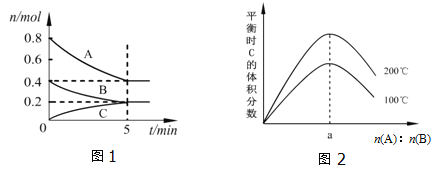
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04molL﹣1min﹣1
B. 图2所知反应xA(g)+yB(g)zC(g)的△H>0,且a=1
C. 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆
D. 200℃时,向容器中充入2mol A和1mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com