
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
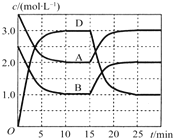
A.反应在前10min的平均反应速率v(B)=0.15mol/( L ·min)
B.该反应的平衡常数表达式K=![]()
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
【答案】C
【解析】
试题分析:由图像可知,前10min,A、B的浓度都减少1.5mol/L,D的浓度增加3.0mol/L,由此可得反应的方程式为:A(g)+B(g) ![]() C(s)+2D(g)。A、由图像可知,10分钟B的浓度改变量为2.5-1.0=1.5mol/L,则反应速率=1.5/10=0.15 mol/(L·min),故A正确;B、在书写平衡常数时固体物质的浓度不写入,则平衡常数为
C(s)+2D(g)。A、由图像可知,10分钟B的浓度改变量为2.5-1.0=1.5mol/L,则反应速率=1.5/10=0.15 mol/(L·min),故A正确;B、在书写平衡常数时固体物质的浓度不写入,则平衡常数为![]() ,故B正确;C、由反应的方程式A(g)+B(g)
,故B正确;C、由反应的方程式A(g)+B(g) ![]() C(s)+2D(g)可知,若平衡温度不变,压缩容器的体积,则平衡不移动,故C错误;、反应到15分钟时,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变条件应是降低温度,故D正确。故选C。
C(s)+2D(g)可知,若平衡温度不变,压缩容器的体积,则平衡不移动,故C错误;、反应到15分钟时,改变条件瞬间,反应混合物的浓度不变,平衡向逆反应移动,该反应正反应为吸热反应,故改变条件应是降低温度,故D正确。故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是
已知:
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

A. 碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.有些活泼金属如铝可作还原剂法的还原剂
B.用电解NaCl溶液的方法来冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收旧金属可以重新制成金属或它们的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒压下,a mol A 和 b mol B 在一个容积可变的容器中发生反应:A(g)+2B(g)![]() 2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
2C(g),一段时间后达到平衡,生成 n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为 1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当 2v 正(A)=v 逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法中,正确的是( )
①纯铁较生铁不易生锈 ②冶炼铝和钠都可以用电解法
③KSCN溶液可以检验Fe3+离子 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥铜与硫反应,生成黑色的CuS
A. ①②③④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 A、B、C、D、M均为中学化学常见物质,它们的转化关系如下图所示(部分生成物和反应条件略去)。A与水的反应在常温下进行。下列推断不正确的是( )
A. 若A为淡黄色固体,则D可能为CO
B. 若M为可溶性铝盐,则D可能为白色沉淀,且M(D)=M(A)
C. 若D为小苏打,C转化为D的反应是CO2+H2O+CO32-=2HCO3-,则A可能为氯气
D. 若C为CO2,则A一定为化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 mol·L-1 | K1=4.4×10-7 mol·L-1 K2=5.6×10-11 mol·L-1- | 3.0×10-8mol·L-1 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+)
B.![]()
C.c(H+)·c(OH-)
D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据增大的是___________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+) __________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是______________________________。

(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池。下图为碱性氢氧燃料电池结构示意图。
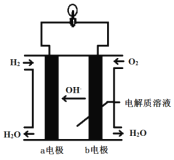
请回答下列问题。
(1)电池是将化学能直接转化为_________能的装置。
(2)氢氧燃料电池中发生反应的化学方程式是____________________。作为碱性氢氧燃料电池,该电池的电解质溶液可以是____________。
(3)b 电极上的反应为O2+2H2O+4e-![]() 4OH-,则该电极为电池的______极。从氧化还原角度分析,该反应属于__________反应。
4OH-,则该电极为电池的______极。从氧化还原角度分析,该反应属于__________反应。
(4)氢氧燃料电池与普通电池相比,其优点是__________________(答出一点即可)。但作为手机电池,长时间使用时,会感觉手机发烫,这是因为有一部分能量转化为_____能,所以它还需要解决一些问题,如:手机壳必须多开一个排气孔,可能的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+、K+、SO42﹣、HCO3﹣
B.Na+、K+、Cl、SO42﹣
C.Cu2+、K+、SO42﹣、NO3﹣
D.Fe2+、K+、NO3﹣、Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com