
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 mol·L-1 | K1=4.4×10-7 mol·L-1 K2=5.6×10-11 mol·L-1- | 3.0×10-8mol·L-1 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+)
B.![]()
C.c(H+)·c(OH-)
D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据增大的是___________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+) __________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是______________________________。

(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=__________。
【答案】
(1)CO32->ClO->HCO3->CH3COO-
(2)A ABCE(3)大于 大于
稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大;
(4)碱 11:9
【解析】
试题分析:
(1)酸根离子对应酸的酸的电离平衡常数越大,则其结合氢离子能力越弱,由于电离平衡常数CH3COOH>H2CO3>HCO3->HClO,则同浓度CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为:CO32->ClO->HCO3->CH3COO-;
(2)A、0.1molL-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,故A正确;B、0.1molL-1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,所以c(H+)/c(CH3COOH)增大,故B错误;C、Kw=c(H+)c(OH-)只受温度的影响,温度不变则其值是一个常数,故C错误;D、醋酸稀释,酸性减弱,c(H+)减小,水的离子积不变,则c(OH-)增大,所以c(OH-)/c(H+)增大,故D错误;E、![]() 为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,故E错误;故答案为:A;若该溶液升高温度,醋酸、水的电离程度都增大,则溶液中氢离子、氢氧根离子浓度都增大。A、升高温度后溶液中氢离子浓度c(H+)增大,故A正确;B、升高温度后氢离子、氢氧根离子浓度都增大,c(H+)/c(CH3COOH),醋酸的浓度减小,则该比值增大,故B正确;C、c(H+)c(OH-)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故C正确;D、c(OH-)/c(H+),升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以该比值减小,故D错误;E、
为醋酸的电离平衡常数,由于温度不变,则水的电离平衡常数不变,故E错误;故答案为:A;若该溶液升高温度,醋酸、水的电离程度都增大,则溶液中氢离子、氢氧根离子浓度都增大。A、升高温度后溶液中氢离子浓度c(H+)增大,故A正确;B、升高温度后氢离子、氢氧根离子浓度都增大,c(H+)/c(CH3COOH),醋酸的浓度减小,则该比值增大,故B正确;C、c(H+)c(OH-)为水的离子积,升高温度后水的电离程度增大,则水的离子积增大,故C正确;D、c(OH-)/c(H+),升高温度后氢氧根离子、氢离子浓度都增大,但氢氧根离子浓度增大的幅度大于氢氧根离子,所以该比值减小,故D错误;E、![]() 为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,故E正确;故答案为:ABCE。
为醋酸的电离平衡常数,升高温度后产生的电离平衡常数增大,故E正确;故答案为:ABCE。
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大;
(4)100℃时,水的离子积为1×10-12,纯水中c(H+)=![]() =10-6 mol/L,则pH=6。该温度下,测得某溶液pH=7,该溶液显碱性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,溶液为酸性,硫酸过量,则有:c(H+)=
=10-6 mol/L,则pH=6。该温度下,测得某溶液pH=7,该溶液显碱性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,溶液为酸性,硫酸过量,则有:c(H+)= ![]() =10-2,则a:b=11:9。
=10-2,则a:b=11:9。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】有关实验装置的说法中正确的是
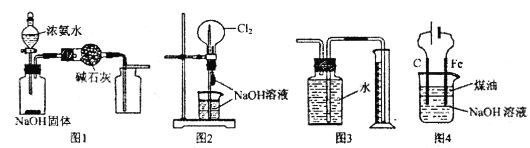
A. 图l装置可制取干燥纯净的NH3
B. 图2装置可以完成“喷泉”实验
C. 图3装置可测量Cu与浓硝酸反应产生气体的体积
D. 图4装置可用于实验室制备Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
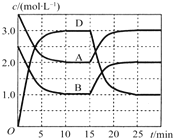
A.反应在前10min的平均反应速率v(B)=0.15mol/( L ·min)
B.该反应的平衡常数表达式K=![]()
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组的同学们利用下图装置,探究不同条件对铁与酸反应速率的影响。

请回答下列问题。
(1)铁与稀硫酸反应的离子方程式是_______________________________________。
(2)适当升高烧瓶内液体的温度,产生气泡的速率将__________(填“加快、”“减慢”或“不变”),由此得出的结论是______________________________________________。
(3)将稀硫酸换为浓硫酸,可观察到_______________,原因是_________________。
(4)向烧瓶中滴入几滴CuSO4溶液,产生气泡的速率明显加快。这是什么原因?
甲同学:CuSO4溶液中的Cu2+对铁与稀硫酸的反应起了催化作用。
乙同学:CuSO4与Fe反应生成了Cu,从而Fe、Cu、稀硫酸构成了原电池,使反应速率加快。
你同意_______的观点,欲证明此观点,可另取一套上图装置,向烧瓶中直接加入少量_____,观察现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 焰色反应是化学变化
B. 电子从基态跃迁到激发态放出能量,产生发射光谱
C. 在一定条件下,碳原子的电子排布式可能是1s22s12p3
D. 自然界的原子都是基态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是

A. R的氧化物都含有离子键
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知分解1mol H2O2放出热量98KJ。在含有少量I![]() 的溶液中,H2O2分解的机理为:
的溶液中,H2O2分解的机理为:
① H2O2+ I![]()
![]() H2O+IO
H2O+IO![]() (慢)②H2O2+ IO
(慢)②H2O2+ IO![]()
![]() H2O+O2+ I
H2O+O2+ I![]() (快)
(快)
下列有关该反应的说法正确的是
A. 反应速率与I![]() 浓度有关 B. IO
浓度有关 B. IO![]() 也是该反应的催化剂
也是该反应的催化剂
C. 该化学反应速率由反应②决定 D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).
A ![]() B
B ![]() C
C
试回答:
(1)若X为O2,则A不可能是______(填选项)
a.NH3 b.Mg c.S d.Si
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因____________________,举出C的一种用途_____________________
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式__________________C的水溶液中各离子浓度由大到小顺序为_______________________.
(4)若A为单质,C为红棕色气体。写出少量Fe粉与组成A物质的元素的最高价氧化物的水化物的稀溶液反应的离子方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com